题目内容
4.运用元素周期律分析下列推断,其中错误的是( )| A. | 铍的最高价氧化物的水化物可能具有两性 | |
| B. | 砹单质是有色固体,砹化氢很不稳定 | |
| C. | 碳酸锶难溶于水,但易溶于盐酸 | |
| D. | 砷的最高价氧化物的水化物是一种强酸 |
分析 A.Be与Al位于对角线位置,性质相似;
B.ⅤⅡA族从上到下非金属性减弱,单质的颜色加深,状态由g→l→s;
C.Ca、Sr位于同主族,化合物性质相似;
D.非金属性N>P>As,非金属性越弱,对应最高价含氧酸的酸性越弱.
解答 解:A.Be与Al位于对角线位置,性质相似,氢氧化铝具有两性,则铍的最高价氧化物的水化物可能具有两性,故A正确;
B.ⅤⅡA族从上到下非金属性减弱,单质的颜色加深,状态由g→l→s,则砹单质是有色固体,砹化氢很不稳定,故B正确;
C.Ca、Sr位于同主族,化合物性质相似,由碳酸钙不溶于水,能溶于盐酸可知,碳酸锶难溶于水,但易溶于盐酸,故C正确;
D.非金属性N>P>As,非金属性越弱,对应最高价含氧酸的酸性越弱,则砷的最高价氧化物的水化物是一种弱酸,故D错误;
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
15.NA表示阿伏加德罗的值,下列有关说法正确的是( )
| A. | 标准状况下,22.4LCH4和CH3CH2OH的混合物所含分子数为NA | |
| B. | 常温常压下,16g14CH4所含中子数数目为8NA | |
| C. | 15.6gNa2O2和水完全反应转移的电子数为0.2NA | |
| D. | 0.1L3mol/L的NH4NO3溶液中含有的NH4+数目为0.3NA |
12.下列条件的改变一定会使平衡发生移动的是( )
| A. | 加催化剂 | B. | 增大压强 | ||
| C. | 升高温度 | D. | 增加反应物的质量 |
19.有机物X能实现下列转化,有机物Z中含有羧基,有机物Y中含有一个羧基,下列判断错误的是( )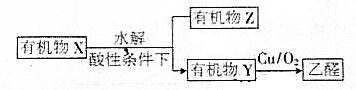

| A. | X可能是淀粉或纤维素 | B. | Y与CH3OCH3互为同分异构体 | ||
| C. | Z可能含有多个羧基 | D. | X中含有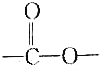 |
9.在镁与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6mol/L,则10s内生成硫酸镁的平均反应速率是( )
| A. | 0.06 mol/(L•s) | B. | 1.8mol/(L•s) | C. | 1.2 mol/(L•s) | D. | 0.18 mol/(L•s) |
16.下列关于有机物的说法正确的是( )
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物,都能发生水解反应 | |
| B. | 蔗糖和葡萄糖不是同分异构体,但属同系物 | |
| C. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| D. | 石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 |
13.电子计算器所用的纽扣式电池为银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Ag2O+Zn+H2O═Zn(OH)2+2Ag,下列叙述中正确的是( )
| A. | 电子由锌经导线流向Ag2O | |
| B. | 负极的电极反应为Zn-2e-═Zn2+ | |
| C. | 溶液中OH-向正极移动 | |
| D. | 随着电极反应的不断进行,电解质的碱性减弱 |
 某有机物A的分子式为C4H8O2,已知A~E有下列转化关系:试回答下列问题:
某有机物A的分子式为C4H8O2,已知A~E有下列转化关系:试回答下列问题: