题目内容
下列说法正确的是( )
| A、NaCl溶液在电流作用下电离成Na+与Cl- |
| B、胶体就是分散质的微粒直径在1 nm~100 nm之间 |
| C、导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多 |
| D、离子反应就是反应物全部以离子的形式存在 |
考点:胶体的重要性质,电解质溶液的导电性
专题:
分析:A.电离是在水分子作用下或者通过加热使化学键断裂离解出自由移动的离子,不需要通电;NaCl溶液在电流作用下发生的是电解;
B.根据胶体的定义;
C.电解质导电能力强弱与自由移动的离子的浓度,所带的电荷多少有关;
D.离子反应是有离子参加的反应.
B.根据胶体的定义;
C.电解质导电能力强弱与自由移动的离子的浓度,所带的电荷多少有关;
D.离子反应是有离子参加的反应.
解答:
解:A.NaCl溶液在电流作用下发生的是电解生成氯气、氢气、氢氧化钠,氯化钠在水溶液中或者在熔融状态下电离成Na+与Cl-,故A错误;
B.因分散质粒子直径在1nm-100nm之间的分散系称为胶体,故B正确;
C.电解质导电能力强弱与自由移动的离子的浓度,所带的电荷多少有关,故C错误;
D.离子反应是有离子参加的反应,反应物不一定全部以离子的形式存在,故D错误.
故选B.
B.因分散质粒子直径在1nm-100nm之间的分散系称为胶体,故B正确;
C.电解质导电能力强弱与自由移动的离子的浓度,所带的电荷多少有关,故C错误;
D.离子反应是有离子参加的反应,反应物不一定全部以离子的形式存在,故D错误.
故选B.
点评:本题考查了电解质、电离、电解以及胶体的概念,题目简单,要求同学们加强基本概念的理解和记忆,以便灵活应用,注意电离和电解的条件.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
在下列各溶液中,一定能大量共存的离子组是( )
| A、强碱性溶液中:K+、Mg2+、Cl-、SO42- |
| B、水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ |
| C、所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
| D、室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
下列有关0.1mol?L-1 NaOH 溶液的叙述正确的是( )
| A、0.1L该溶液中含有NaOH 4.0g |
| B、从1L该溶液中取出100mL,所取出的NaOH溶液的浓度为0.01 mol?L-1 |
| C、100 mL该溶液中含有OH-0.01mol |
| D、在1 L水中溶解4g NaOH即可配制得0.1 mol?L-1NaOH溶液 |
下列离子方程式正确的是( )
| A、利用醋酸溶解含碳酸钙的水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、用铜为电极电解饱和食盐水:2Cl-+2H2O═Cl2↑+H2↑+2OH- |
| C、在明矾溶液中滴加过量氨水:Al3++4NH3?H2O=AlO2+4NH4++2H2O |
| D、在小苏打溶液中加少量 Ba(OH)2 溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- |
下列排序错误的是( )
| A、酸性:HClO4>H2SO4>H3PO4 |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、沸点:NH3>PH3>AsH3 |
| D、熔点:Si3N4>NaCl>SiCl4 |
在下列各溶液中,一定能大量共存的离子组是( )
| A、常温下pH=7的溶液中:Fe3+、Na+、Cl-、SCN- |
| B、常温下c(OH-)/c(H+)=1014的溶液中:K+、Mg2+、Cl-、Br- |
| C、含有大量HCO3-的澄清透明溶液中:K+、C6H5O-、Cl-、Na+ |
| D、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+ |
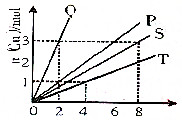 铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列反应:
铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列反应: