题目内容
利用下列各组中的物质制备并收集少量相应的气体,能采用图装置的是( )

| A、过氧化氢溶液和二氧化锰制O2 |
| B、稀硝酸和铜片制NO |
| C、浓盐酸和二氧化锰制Cl2 |
| D、锌粒和稀硫酸制H2 |
考点:气体发生装置,气体的收集
专题:实验设计题
分析:根据装置图可以看出,在不加热的条件下固体和液体反应制备气体,生成气体可用向上排空法收集,说明气体的密度比空气大,没有尾气吸收装置,说明气体无毒,据此即可解答.
解答:
解:A.过氧化氢在二氧化锰的催化作用下分解为氧气,氧气密度比空气的大且无污染,故A选;
B.铜片和稀硝酸反应生成一氧化氮气体,一氧化氮能被氧气氧化为二氧化氮,不能用排空气法收集,故B不选;
C.二氧化锰和浓盐酸反应生成氯气,氯气有毒,应有尾气吸收装置,且反应需要加热才能进行,故C不选;
D.锌和稀硫酸生成氢气,氢气密度比空气小,应用向下排空气法收集,故D不选.
故选A.
B.铜片和稀硝酸反应生成一氧化氮气体,一氧化氮能被氧气氧化为二氧化氮,不能用排空气法收集,故B不选;
C.二氧化锰和浓盐酸反应生成氯气,氯气有毒,应有尾气吸收装置,且反应需要加热才能进行,故C不选;
D.锌和稀硫酸生成氢气,氢气密度比空气小,应用向下排空气法收集,故D不选.
故选A.
点评:本题考查气体的制备装置,题目难度不大,根据气体制备、干燥、收集,明确气体的性质是解答该题的关键,做题时一定要仔细观察实验装置.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
在室温下,pH相同、体积相同的氨水和氢氧化钠溶液,采取下列措施后,有关叙述正确的是( )
| A、温度下降20℃,两溶液的pH均不变 |
| B、各加水稀释10倍,两溶液的pH仍相等 |
| C、分别加入适量的氯化铵晶体,两溶液的pH均减小 |
| D、各用相同物质的量浓度的盐酸中和,所消耗盐酸的体积相等 |
将氮气、一氧化碳、二氧化碳的混合气体先通过足量澄清石灰水,再通过足量灼热的氧化铜,最后剩余的气体是( )
| A、氮气 | B、二氧化碳 |
| C、一氧化碳 | D、二氧化碳和氮气 |
以下5种有机物的分子式都是C4H10O:
① ②
② ③
③ ④
④ ⑤CH3CH2OCH2CH3.
⑤CH3CH2OCH2CH3.
其中能被氧化为含相同碳原子数的醛的是( )
①
 ②
② ③
③ ④
④ ⑤CH3CH2OCH2CH3.
⑤CH3CH2OCH2CH3.其中能被氧化为含相同碳原子数的醛的是( )
| A、①② | B、只有② |
| C、②③ | D、③④⑤ |
M、N为短周期的两种元素,M元素原子的最外层电子数≤4,N元素原子的最外层电子数>4,下列对其中说法正确的是( )
| A、M、N可能为金属 |
| B、若M、N为同周期元素,则原子半径M<N |
| C、M、N元素的单质可能与水发生置换反应 |
| D、M、N形成的离子化合物不能体现强氧化性 |
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示:

关于咖啡鞣酸的下列叙述正确的是( )

关于咖啡鞣酸的下列叙述正确的是( )
| A、分子式为C16H13O9 |
| B、1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应 |
| C、能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键 |
| D、与浓溴水能发生两种类型的反应 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
| B、标准状况下,2.24 L Cl2与过量NaOH溶液反应,转移的电子总数为0.2NA |
| C、1 mol/L的NaOH溶液中含Na+数目为NA |
| D、标准状况下,11.2 L CCl4中的C-Cl键数目为2NA |
某气态烃10mL与50mL氧气在一定条件下作用,刚好耗尽反应物,生成水蒸气40mL、一氧化碳和二氧化碳各20mL(各体积都是在同温同压下测得).该气态烃为( )
| A、C3H8 |
| B、C4H6 |
| C、C3H6 |
| D、C4H8 |
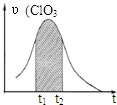 KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图.下列说法正确的( )
KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图.下列说法正确的( )| A、反应开始时速率增大可能是c(H+)所致 |
| B、纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合 |
| C、后期速率υ下降的主要原因是反应向逆反应方向进行 |
| D、图中阴影“面积”可以表示t1-t2时间内c(Cl-)增加量 |