题目内容
20. X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,Y是地壳中含量最多的元素,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,Y是地壳中含量最多的元素,下列说法中正确的是( )| A. | 非金属性:X>Y | |
| B. | 原子半径:Z>W>X>Y | |
| C. | 氢化物的沸点:Z>Y | |
| D. | W的单质能水反应,生成一种具有漂白性的物质 |
分析 X、Y、Z、W均为短周期元素,Y是地壳中含量最多的元素,则Y为O元素,由元素相对位置可知,X为N元素、Z为S元素、W为Cl.
A.同周期自左而右元素非金属性增强;
B.同周期自左而右原子半径减小,一般电子层越多原子半径越大;
C.水分子之间存在氢键,沸点高于硫化氢的;
D.氯气与水反应生成HCl与HClO,HClO具有漂白性.
解答 解:X、Y、Z、W均为短周期元素,Y是地壳中含量最多的元素,则Y为O元素,由元素相对位置可知,X为N元素、Z为S元素、W为Cl.
A.同周期自左而右元素非金属性增强,故非金属性X(N)<Y(O),故A错误;
B.同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径:Z>W>X>Y,故B正确;
C.水分子之间存在氢键,沸点高于硫化氢的,故C错误;
D.氯气与水反应生成HCl与HClO,HClO有强氧化性,具有漂白性,故D正确,
故选:BD.
点评 本题考查位置结构性质的关系应用,关键是推断元素,熟练掌握元素周期律与元素周期表结构,难度不大.

练习册系列答案
相关题目
14.如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).
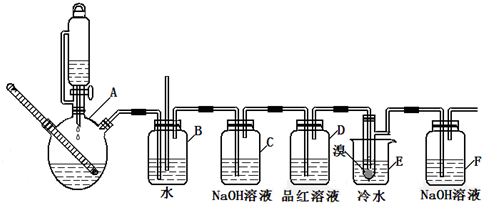
有关数据如表:
请按要求回答下列问题:
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)下列有关A中反应说法错误的是AD(填编号)
A.将乙醇缓慢加入浓硫酸中配制混合酸
B.温度在140℃时,其主要反应为取代反应
C.浓硫酸的作用是脱水和催化
D.加入碎瓷片的作用是加快反应速度
(3)装置D中品红溶液的作用是验证二氧化硫是否被除尽;同时B装置是安全瓶,监测实验进行时E中是否发生堵塞,请写出堵塞时的现象玻璃管中液面上升.
(4)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发,但又不能用冰水,其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(5)装置F中的化学反应方程式为:Br2+2NaOH=NaBr+NaBrO+H2O.

有关数据如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)下列有关A中反应说法错误的是AD(填编号)
A.将乙醇缓慢加入浓硫酸中配制混合酸
B.温度在140℃时,其主要反应为取代反应
C.浓硫酸的作用是脱水和催化
D.加入碎瓷片的作用是加快反应速度
(3)装置D中品红溶液的作用是验证二氧化硫是否被除尽;同时B装置是安全瓶,监测实验进行时E中是否发生堵塞,请写出堵塞时的现象玻璃管中液面上升.
(4)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发,但又不能用冰水,其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(5)装置F中的化学反应方程式为:Br2+2NaOH=NaBr+NaBrO+H2O.
9.下列有关物质的应用说法正确的是( )
| A. | 碳酸钠可作胃酸的中和剂 | B. | SiO2可用于制造太阳能电池 | ||
| C. | 铁经常用作红色油漆和涂料 | D. | 生石灰用作食品抗氧化剂 |
10.已知部分弱酸的电离平衡常数如下表:
下列离子方程式正确的是( )
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 (25℃) | Ka=1.75ⅹ10-5 | Ka=2.98ⅹ10-8 | Ka1=4.3ⅹ10-7 Ka2=5.61ⅹ10-11 | Ka1=1.54ⅹ10-2 Ka2=1.02ⅹ10-7 |
| A. | 少量的CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO | |
| B. | 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| C. | 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+2H2O |
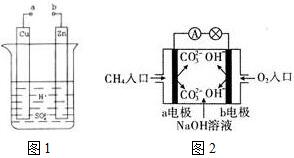 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献.