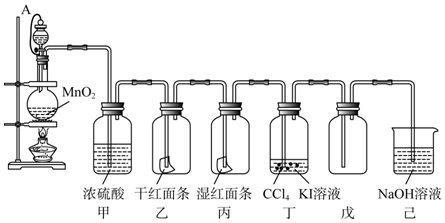
题目内容
3.实验室通常利用质量分数36.5%盐酸(密度为1.14g/mL)与二氧化锰通过反应制取Cl2.通过计算回答下列问题:(1)质量分数36.5%(密度为为1.14g/mL)盐酸的物质的量浓度为多少?
(2)若要制取标况下Cl22.24L(标准状况),理论上需要消耗MnO2多少克?
(3)此时,被氧化HCl的物质的量为多少?
分析 (1)利用c=$\frac{1000ρw}{M}$计算盐酸的浓度;
(2)利用MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O,计算消耗MnO2的质量;
(3)被氧化HCl的物质的量是氯气物质的量的两倍.
解答 解:(1)由c=$\frac{1000ρw}{M}$可知,盐酸的浓度为$\frac{1000×1.14×36.5%}{36.5}$mol/L=11.4mol/L,答:盐酸的物质的量浓度为11.4mol/L;
(2)标况下Cl22.24L,其物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O可知,n(MnO2)=n(C12),则消耗的质量为0.1mol×87g/mol=8.7g,答:理论上需要消耗MnO28.7g;
(3)被氧化HCl的物质的量是氯气物质的量的两倍,所以被氧化HCl的物质的量为2×0.1mol=0.2mol,答:被氧化HCl的物质的量为0.2mol.
点评 本题考查氧化还原反应、离子反应及浓度的计算,考查知识较基础,学生应注重归纳、熟记公式等来解答即可,题目难度不大.

练习册系列答案
相关题目
13.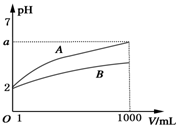 pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
 pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )| A. | 稀释后A溶液的酸性比B溶液弱 | |
| B. | a=5时,A是强酸,B是弱酸 | |
| C. | 若A、B都是弱酸,则5>a>2 | |
| D. | A、B两种酸溶液物质的量浓度一定相等 |
14.下列有关石油及石油加工的说法中,正确的是( )
| A. | 石油是各种液态烃的混合物 | |
| B. | 常压分馏的原料是重油 | |
| C. | 由分馏塔分馏出的各馏分均是混合物 | |
| D. | 减压分馏的主要产品有汽油、润滑油、煤油和沥青 |
18.以下物质间的每步转化通过一步反应能实现的是( )
| A. | Si→SiO2→H2SiO4→Na2SiO3 | B. | Fe→FeCl2→FeCl3→Fe(OH)3 | ||
| C. | Na→Na2CO2→Na2O2→NaOH | D. | Al→Al2O3→Al(OH)3→NaAlO2 |
8.“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
| A. | 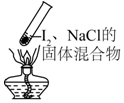 加热时,上部汇聚了固体碘,说明碘的热稳定性较差 | |
| B. | 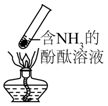 加热时,中部溶液变红,冷却后又变为无色 | |
| C. | 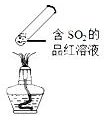 加热时,中部溶液变红,冷却后又变为无色 | |
| D. |  \加热时,上部汇聚了白色固体,说明氯化铵易升华 |
15.用下列实验装置完成对应的实验(部分仪器已省),能达到实验目的是( )
| A. | 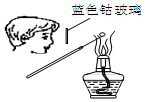 检验Na2CO3 中的Na+ | B. | 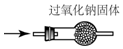 除去CO中混有的CO2 | ||
| C. | 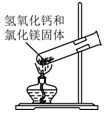 制取氨气 | D. | 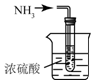 吸收氨气 |
12.根据下列所述事实书写离子方程式不正确的是( )
| A. | 用稀硫酸溶解四氧化三铁:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | Ca(HCO2)2溶液中滴加Ba(OH)2溶液至呈中性:Ca2++2HCO3-+Ca2++2OH-═2H2O+BaCO3↓+CaCO3↓ | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向次氯酸钠溶液中通入SO2:2ClO-+SO2+H2O═SO32-+2HClO |
2.下列化学术语或表示方法错误的是( )
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 醋酸的分子式:CH3COOH | |
| D. | 乙醇的结构式为: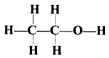 |