题目内容
13.常温下、0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后(假设混合液体积为二者之和),所得溶液中部分微粒组分及浓度如图所示,下列说法不正确的是( )
| A. | HA是弱酸 | B. | 该混合液pH>7 | ||
| C. | 该混合溶液中:c(A-)+c(Y)=c(Na+) | D. | 图中X表示HA,Y表示OH-,Z表示H+ |
分析 等浓度、等体积的HA和NaOH溶液混合,二者恰好完全反应生成NaA,如果NaA不水解,则c(A-)=0.1mol/L,根据图知c(A-)<0.1mol/L,说明HA是弱酸,则NaA是强碱弱酸盐,溶液中存在电荷守恒、物料守恒,据此分析解答.
解答 解:等浓度、等体积的HA和NaOH溶液混合,二者恰好完全反应生成NaA,如果NaA不水解,则c(A-)=0.1mol/L,根据图知c(A-)<0.1mol/L,说明HA是弱酸,
A.通过以上分析知,HA是弱酸,故A正确;
B.NaA是强碱弱酸盐,弱酸根离子水解导致溶液呈碱性,则混合溶液pH>7,故B正确;
C.该混合溶液中水电离、A-水解都生成OH-,只有A-水解生成HA,溶液中c(HA)<c(OH-),溶液中c(HA)接近等于c(OH-),所以c(H+)最小,所以Y表示HA,根据物料守恒得c(A-)+c(Y)=c(Na+),故C正确;
D.通过C分析知,X、Y、Z分别表示OH-,Y表示HA,Z表示H+,故D错误;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生图象分析、判断能力,正确判断HA酸性强弱及图中各微粒名称是解本题关键,题目难度中等.

练习册系列答案
相关题目
4.学习化学时会遇到很多“相等”,下列有关“相等”的说法中错误的是( )
| A. | 原子中核内质子数和核外电子数一定相等 | |
| B. | 溶液稀释前后溶质的质量一定相等 | |
| C. | 常温常压下,酸碱中和反应生成1mol液态水时放出的热量一定相等 | |
| D. | 物质发生化学变化前后,元素的种类一定相等 |
1.在下列5种物质沸点的排列顺序中,正确的是( )
①正丁烷 ②异丁烷 ③正戊烷 ④异戊烷 ⑤新戊烷.
①正丁烷 ②异丁烷 ③正戊烷 ④异戊烷 ⑤新戊烷.
| A. | ①>②>③>④>⑤ | B. | ③>④>⑤>①>② | C. | ⑤>④>③>②>① | D. | ②>①>⑤>④>③ |
18.固体NH4I在密闭容器中受热分解发生下列反应:NH4I(s)?NH3(g)+HI(g);2HI(g)?H2(g)+I2(g)达到平衡时,c(HI)=4mol/L,c(I2)=0.5mol/L,下列说法正确的是( )
| A. | 平衡时HI的分解率20% | B. | 反应起始时固体NH4I是5 mol | ||
| C. | 平衡时,c (NH3)=4.5mol/L | D. | 平衡时HI的分解率10% |
5.下列对于“摩尔”的理解不正确的是( )
| A. | 摩尔是一个物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 1mol12C与0.012kg12C所含碳原子数相同 | |
| D. | 1molO2约含6.02×1023个氧分子 |
3.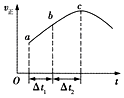 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 反应物的总能量低于生成物的总能量 | |
| B. | △t1=△t2时,CO的转化率:a~b段小于b〜c段 | |
| C. | 反应在c点达到平衡状态 | |
| D. | 反应物浓度:a点小于b点 |
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题: