题目内容
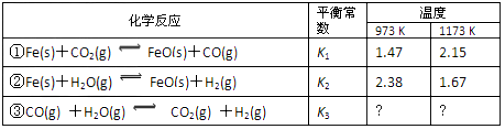
14.A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素.| A | ||
| E |
 .
.(2)AE2的分子式为CS2.
(3)C、E、F的单质沸点最低的是O2(填化学式).
(4)C、D、E、F的离子半径由大到小的顺序是S2->Cl->O2->Al3+(填离子符号).
(5)实验室制取F2气体的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
分析 A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A与氧元素能形成两种无色气体CO、CO2,则A为C元素;结合A、E在元素周期表中的相对位置可知E为S元素;C是地壳中含量最多的元素,C为O元素,D是地壳中含量最多的金属元素,D为Al元素,F的原子序数最大,F只能为Cl,以此来解答.
解答 解:(1)C为O,在元素周期表中的位置为第二周期第ⅥA族,O其离子的结构示意图为 ,故答案为:第二周期第ⅥA族;
,故答案为:第二周期第ⅥA族; ;
;
(2)AE2的分子式为,故答案为:CS2;
(3)常温下S为固体,氧气与氯气均为气体,相对分子质量大的沸点高,则C、E、F的单质沸点最低的是O2,故答案为:O2;
(4)电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则C、D、E、F的离子半径由大到小的顺序是S2->Cl->O2->Al3+,故答案为:S2->Cl->O2->Al3+;
(5)实验室制取Cl2气体的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(6)NH3的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,反应生成氮气与水,化学方程式为:2NH3•H2O+3H2O2=N2↑+8H2O,
故答案为:2NH3•H2O+3H2O2=N2↑+8H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
4.学习化学时会遇到很多“相等”,下列有关“相等”的说法中错误的是( )
| A. | 原子中核内质子数和核外电子数一定相等 | |
| B. | 溶液稀释前后溶质的质量一定相等 | |
| C. | 常温常压下,酸碱中和反应生成1mol液态水时放出的热量一定相等 | |
| D. | 物质发生化学变化前后,元素的种类一定相等 |
5.下列对于“摩尔”的理解不正确的是( )
| A. | 摩尔是一个物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 1mol12C与0.012kg12C所含碳原子数相同 | |
| D. | 1molO2约含6.02×1023个氧分子 |
9.亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(所 加试剂均足量).
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 亚硫酸盐作为食品添加剂,作用是防腐保鲜 | |
| B. | 反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
19.化学与生产、生活、科技等密切相关,下列说法正确的是( )
| A. | 石油裂解的目的是提高柴油等轻质油的产量和质量 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 煤经气化和液化两个化学变化过程,可变为清洁能源 |
6.以石化产品乙烯、丙烯为原料合成厌氧胶的流程如图.

关于该过程的相关叙述正确的是( )

关于该过程的相关叙述正确的是( )
| A. | 反应④的反应类型是加聚 | B. | 物质A含有两种官能团 | ||
| C. | 物质B催化氧化后可以得到乙醛 | D. | 1mol物质D最多可以消耗2molNaOH |
3.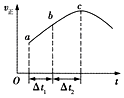 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 反应物的总能量低于生成物的总能量 | |
| B. | △t1=△t2时,CO的转化率:a~b段小于b〜c段 | |
| C. | 反应在c点达到平衡状态 | |
| D. | 反应物浓度:a点小于b点 |
20.一定温度、压强下,若一个氦原子实际质量是b g,12C的原子实际质量是a g,氦气的密度为ρ g/cm3,该温度压强下氦气的摩尔体积为Vm L/mol,NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 氦原子的相对原子质量是$\frac{12a}{b}$ | B. | 氦气的摩尔质量是(ρVm) g/mol | ||
| C. | m g氦气所含质子数是$\frac{2m}{b}$ | D. | m g氦气的物质的量是$\frac{m}{(b{N}_{A})}$ |