题目内容
运用杂化轨道理论解释CH4,NH3,H2O,C2H4,C2H2的立体结构型并将每种杂化用电子排布图表示.
考点:原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:根据价层电子对互斥理论确定分子的空间构型及原子杂化方式,价层电子对数=σ键个数+孤电子对个数,据此分析解答.
解答:
解:CH4中中心原子C价层电子对数=4+
(4-4×1)=4,且不含孤电子对,所以C原子采用sp3杂化,其空间构型为正四面体型,
NH3中中心原子价层电子对数=3+
(5-1×3)=4,为sp3杂化,有一对孤电子对,空间结构为三角锥形,
H2O中中心原子价层电子对数=2+
(6-1×2)=4,为sp3杂化,有2对孤电子对,空间结构为V型;
C2H4中每个碳原子价层电子对个数为3且不含孤电子对,所以C原子采用sp2杂化,且平面结构,
C2H2的结构式为H-C≡C-H,每个碳原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化,为直线形,
sp杂化电子排布图为 ,sp2杂化电子排布图为
,sp2杂化电子排布图为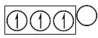 ,sp3杂化电子排布图为
,sp3杂化电子排布图为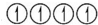 ,
,
答:CH4,NH3,H2O,C2H4,C2H2的立体结构型分别为正四面体型、三角锥形、V型、平面结构、直线形,sp杂化电子排布图为 ,sp2杂化电子排布图为
,sp2杂化电子排布图为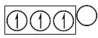 ,sp3杂化电子排布图为
,sp3杂化电子排布图为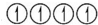 .
.
| 1 |
| 2 |
NH3中中心原子价层电子对数=3+
| 1 |
| 2 |
H2O中中心原子价层电子对数=2+
| 1 |
| 2 |
C2H4中每个碳原子价层电子对个数为3且不含孤电子对,所以C原子采用sp2杂化,且平面结构,
C2H2的结构式为H-C≡C-H,每个碳原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化,为直线形,
sp杂化电子排布图为
 ,sp2杂化电子排布图为
,sp2杂化电子排布图为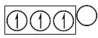 ,sp3杂化电子排布图为
,sp3杂化电子排布图为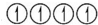 ,
,答:CH4,NH3,H2O,C2H4,C2H2的立体结构型分别为正四面体型、三角锥形、V型、平面结构、直线形,sp杂化电子排布图为
 ,sp2杂化电子排布图为
,sp2杂化电子排布图为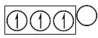 ,sp3杂化电子排布图为
,sp3杂化电子排布图为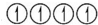 .
.
点评:本题考查了原子杂化方式的判断,根据价层电子对互斥理论解答即可,注意孤电子对个数的计算方法,知道其表达式中各个字母的含义,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关铁及其化合物的描述中不正确的是( )
| A、Fe3+离子只具有氧化性,Fe只具有还原性 |
| B、除去FeCl2溶液中混有的少量FeCl3,最好的方法是通入氯气 |
| C、Fe2+的水溶液为浅绿色,Fe2+既有氧化性又有还原性 |
| D、Fe3+的水溶液为棕黄色,可用含SCN-的溶液检验 |
下列物质属于电解质且又能导电的是( )
| A、硝酸钾溶液 |
| B、液态的氯化氢 |
| C、熔融的氯化钠 |
| D、金属铜 |
下列反应中,必须加入氧化剂才能进行的是( )
| A、Cl2→ClO- |
| B、Zn→Zn2+ |
| C、Na2O2→O2 |
| D、CuO→CuCl2 |
下列变化中,能表明硝酸具有氧化性的是( )
| A、石蕊试剂变红色 |
| B、能跟Ag反应生成AgNO3 |
| C、碳酸钙反应 |
| D、能和FeO反应生成Fe(NO3)3 |
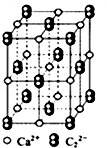 CaC2晶体的晶胞结构与NaCl的相似(如图),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )
CaC2晶体的晶胞结构与NaCl的相似(如图),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )| A、6.4克CaC2晶体中含阴离子0.2 mol |
| B、该晶体中的阴离子与N2是互为等电子体 |
| C、1个Ca2+周围距离最近且等距离的C22-数目为6 |
| D、与每个Ca2+距离相等且最近的Ca2+共有12个 |
下列说法错误的是( )
| A、不同条件下,1mol任何气体所含分子个数均相同 |
| B、1mol任何气体的体积均为22.4L |
| C、1mol气体在压强一定时,50℃时体积比20℃时体积大 |
| D、1LO2和1LO3在同温同压下具有相同数目的分子 |
下列所示装置中的实验能达到目的是( )
A、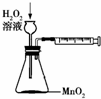 用以定量测定化学反应速率 |
B、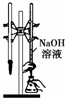 为用已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验 |
C、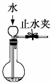 可以检查装置的气密性 |
D、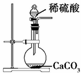 为实验室制取少量CO2的发生装置 |