题目内容
18.现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原Na[Au(CN)2]生成金.“浸取”反应的氧化剂是O2,消耗的锌与生成的金物质的量之比为1:2.分析 由题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2]( 二氰合金酸钠)溶液,利用元素守恒可书写化学方程式,根据电子得失守恒可计算出消耗的锌与生成的金的物质的量之比,以此来解答.
解答 解:题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2]( 二氰合金酸钠)溶液,反应的化学方程式为4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,O元素的化合价降低,则为氧化剂,还原1mol金要转移1mol电子,而每mol锌能转移2mol电子,所以消耗的锌与生成的金的物质的量之比为1:2,
故答案为:O2;1:2.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
8.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
(1)请根据上述信息判断下列反应不能发生的是BD(填编号).
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
D.HCN+Na2CO3→NaCN+CO2+H2O
(2)已知常温时Ksp(AgCl)=1.8×10-10mol2•L-2,向50mL 0.18mol•L-1的AgNO3溶液中加入相同体积0.22mol•L-1的盐酸,则c(Ag+)=9.0×10-8mol/L.
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
D.HCN+Na2CO3→NaCN+CO2+H2O
(2)已知常温时Ksp(AgCl)=1.8×10-10mol2•L-2,向50mL 0.18mol•L-1的AgNO3溶液中加入相同体积0.22mol•L-1的盐酸,则c(Ag+)=9.0×10-8mol/L.
9.下列物质的变化,不能通过一步化学反应完成的是( )
| A. | CO2→H2CO3 | B. | Al(OH)3→Al2O3 | C. | Na2O2→Na2CO3 | D. | SiO2→H2SiO3 |
13.在通常情况下不能共存,但均可用浓硫酸干燥的是( )
| A. | H2,H2S,SO2 | B. | N2,Cl2,HBr | C. | CO2,O2,NO | D. | NH3,CO2,HCl |
1.下列四种化学操作名称从左到右分别是( )
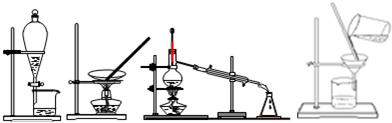

| A. | 过滤、蒸发、蒸馏、萃取 | B. | 过滤、蒸馏、蒸发、萃取 | ||
| C. | 蒸发、蒸馏、过滤、萃取 | D. | 萃取、蒸发、蒸馏、过滤 |
6.下列对应操作正确且能达到实验目的是( )
| A. |  用图装置验证化学能转化为电能 | B. |  用图装置量取15.00mL KMnO4溶液 | ||
| C. | 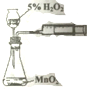 用图装置测定该化学反应速率 | D. | 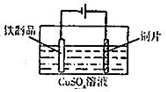 用图装置在铁制品表面镀铜 |
