题目内容
常温下,Ksp[Mn(OH)2]=2×10-13,实验室制氯气的废液中含Mn2+离子浓度为0.1mol/L-1,向该溶液中滴加稀氢氧化钠溶液至Mn2+离子完全沉淀的最小pH值为( )
A、8+
| ||
| B、9+lg2 | ||
C、10+
| ||
| D、11+2lg2 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:Mn2+沉淀较为完全[c(Mn2+)<1×10-5mol/L],根据Ksp求出OH-离子的浓度,再根据Kw求出氢离子的浓度,然后求pH,选择即可.
解答:
解:Mn2+沉淀较为完全时的浓度为1×10-5mol/L,已知Ksp=c(Mn2+)×c2(OH-),
则c(OH-)=
=
mol/L=
×10-4mol/L,
则c(H+)=
=
mol/L=
×10-10mol/L,
所以pH=-lg
×10-10=10+
lg2,故选C.
则c(OH-)=
|
|
| 2 |
则c(H+)=
| KW |
| c(OH-) |
| 10-14 | ||
|
| ||
| 2 |
所以pH=-lg
| ||
| 2 |
| 1 |
| 2 |
点评:本题考查溶度积常数的计算和PH的计算,题目难度不大,注意把握计算公式的运用.

练习册系列答案
相关题目
下列说法正确的是( )
| A、等质量的白磷蒸气和白磷固体分别完全燃烧,后者放出的热量多 |
| B、人类日常利用的煤、天然气、石油等的能量,归根到底是由太阳能转变来的 |
| C、燃烧热是指1mol物质完全燃烧时放出的热量 |
| D、在101 kPa、25℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ的热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ?mol-1 |
NA代表阿伏加德罗常数的数值,下列叙述正确的是( )
| A、在 H2O2+Cl2=2HCl+O2反应中,每生成32 gO2,转移4NA个电子 |
| B、一定条件下,56 g Fe与33.6 L Cl2充分反应,转移电子数一定为3NA |
| C、标准状况下分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D、在1 L 0.2 mol?L-1的硫酸铝溶液中含有的铝离子数为0.4NA |
下列关于氧化物的叙述正确的是( )
| A、金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物 |
| B、酸性氧化物都能与水化合生成酸 |
| C、碱性氧化物都能与水化合生成碱 |
| D、碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 |
绿色化学对于化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想的原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放.下列反应类型中完全符合要求的是( )
| A、分解反应 | B、置换反应 |
| C、复分解反应 | D、化合反应 |
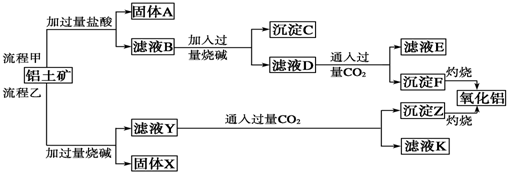
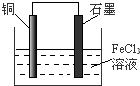
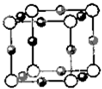 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题: