题目内容
4.下列说法不正确的是( )| A. | 根据对角线规则,镁元素和锂元素的性质具有相似性 | |
| B. | 一般来说,共价键键长越短,键能越大 | |
| C. | 气体单质分子中,一定有σ键,可能有π键 | |
| D. | 金属焰色反应原理是激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量 |
分析 A.处于周期表对角线位置的元素,性质相似;
B.共价键键长越短,原子间的作用力越大,共价键越稳定;
C.单原子气体分子中不含有共价键;
D.电子从高能态跃迁到低能态时,要释放能量.
解答 解:A.处于周期表对角线位置的元素,性质相似,镁元素和锂元素在周期表中位于对角线上,性质具有相似性,故A正确;
B.共价键键长越短,原子间的作用力越大,共价键越稳定,破坏共价键需要的能量越多,所以键能越大,故B正确;
C.单原子气体分子中不含有共价键,如稀有气体是单原子分子,分子中没有共价键,即没有σ键和π键,故C错误;
D.电子从高能态跃迁到低能态时,要释放能量,所以金属焰色反应原理是激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量,故D正确.
故选C.
点评 本题考查较为综合,涉及元素周期表、共价键键能、σ键和π键、电子跃迁等知识,综合考查学生对化学知识的应用和理解,题目难度不大,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ•mol-1.
实验测得起始、平衡时的有关数据如表所示:
下列叙述错误的是( )
N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ•mol-1.
实验测得起始、平衡时的有关数据如表所示:
| 容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 平衡时,两个容器中NH3的体积分数相等 | |
| C. | 若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ | |
| D. | 容器②中达平衡时放出的热量Q=23.15 kJ |
15.利用实验器材(规格和数量不限)能完成相应实验的一项是( )
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、蒸发皿 | CuSO4溶液的浓缩结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去BaSO4中少量的BaCO3 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体NaCl配制0.5mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中少量的NaI |
| A. | A | B. | B | C. | C | D. | D |
19.某元素的原子核外电子排布中,K能层和L能层电子数之和等于L能层和M能层的电子数之和,则该元素的原子( )
| A. | 具有稀有气体的原子结构 | B. | 含有的质子和中子数一定相等 | ||
| C. | M能层的电子能量最高 | D. | 核外L层上的电子数是K层的5倍 |
9.下列有机物分子中,在核磁共振氢谱中信号强度(个数比)是1:3的是( )
| A. | 丙烷 | B. | 1,2,3三甲基苯 | C. | 异丙醇 | D. |  |
13.下列说法不正确的是( )
| A. | 胶体的分散质能通过滤纸孔隙 | |
| B. | 利用高纯度单质硅等可以制成光电池,将光能直接转化为电能 | |
| C. | 节日里燃放的烟花五彩缤纷,其实是碱金属以及锶、钡等金属化合物焰色反应所呈现的各种艳丽色彩 | |
| D. | 发生化学反应的充要条件是活分子之间发生“有效碰撞”,恒压条件下,对于一个可逆反应,正反应的活化能与逆反应的活化能之差是该反应的焓变,而一定不是反应热 |
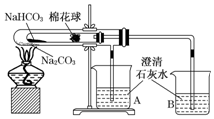 “套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题:
“套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题: