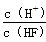题目内容
黄铁矿是工业上制取硫酸的主要原料,其主要成分为FeS2,含少量杂质(杂质不含S元素,且高温下不反应).某化学兴趣小组用下列装置测定黄铁矿中硫元素的质量分数.

称取2.0g研细的黄铁矿样品,将样品放入石英管中,缓慢鼓入空气,再加热石英管至800~850℃;锥形瓶中盛装100mL 0.2mol/L酸性KMnO4溶液用于吸收SO2(忽略SO2、H2SO3与氧气反应);反应结束后,每次从锥形瓶中取出25.00mL溶液,用0.23mol/L标准H2C2O4溶液滴定,重复三次.
已知:4FeS2+11O2
2Fe2O3+8SO2;2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
请回答下列问题:
(1)连接好装置,检查装置气密性的操作是 .
(2)通入空气的作用是 .
(3)若实验过程中鼓入空气的速率过快,则测得的硫元素的质量分数 .(填“偏高”、“偏低”或“不变”)
(4)滴定时,应选择右图中的 (填字母序号)盛装标准H2C2O4溶液,根据 现象来判断滴定已经达到终点.
(5)滴定过程中发生反应的离子方程式是 .
(6)如果黄铁矿中的硫全部转化为SO2,且被酸性KMnO4溶液完全吸收,滴定操作中,平均耗用0.23mol/L标准H2C2O4溶液21.73mL,则黄铁矿样品中硫元素的质量分数是 .(保留到小数点后1位)

称取2.0g研细的黄铁矿样品,将样品放入石英管中,缓慢鼓入空气,再加热石英管至800~850℃;锥形瓶中盛装100mL 0.2mol/L酸性KMnO4溶液用于吸收SO2(忽略SO2、H2SO3与氧气反应);反应结束后,每次从锥形瓶中取出25.00mL溶液,用0.23mol/L标准H2C2O4溶液滴定,重复三次.
已知:4FeS2+11O2
| ||
请回答下列问题:
(1)连接好装置,检查装置气密性的操作是
(2)通入空气的作用是
(3)若实验过程中鼓入空气的速率过快,则测得的硫元素的质量分数
(4)滴定时,应选择右图中的
(5)滴定过程中发生反应的离子方程式是
(6)如果黄铁矿中的硫全部转化为SO2,且被酸性KMnO4溶液完全吸收,滴定操作中,平均耗用0.23mol/L标准H2C2O4溶液21.73mL,则黄铁矿样品中硫元素的质量分数是
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)向锥形瓶中加水浸没导气管末端,关闭K,溶解微热石英管,根据锥形瓶中是否有气泡冒出,及冷却后导管内是否形成一端稳定的气柱判断该装置的稳定性;
(2)空气中含有氧气,空气还能够将生成的二氧化硫驱赶到锥形瓶中;
(3)若鼓入的空气速率过快,导致二氧化硫没有完全被酸性高锰酸钾溶液吸收;
(4)A为碱式滴定管,B为酸式滴定管,草酸为酸性溶液,应该使用酸式滴定管;滴定结束前溶液为紫红色,滴定结束后变为无色,据此判断滴定终点;
(5)草酸与高锰酸根离子、氢离子发生氧化还原反应生成锰离子、二氧化碳气体和水;
(6)根据反应5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O及草酸的量计算出25mL溶液中剩余的高锰酸钾的物质的量,再计算出100ml溶液中剩余的高锰酸钾的物质的量,从而得出二氧化硫消耗的高锰酸钾的物质的量,再根据反应2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4计算出二氧化硫的物质的量,根据S原子守恒计算出样品中S的质量及质量分数.
(2)空气中含有氧气,空气还能够将生成的二氧化硫驱赶到锥形瓶中;
(3)若鼓入的空气速率过快,导致二氧化硫没有完全被酸性高锰酸钾溶液吸收;
(4)A为碱式滴定管,B为酸式滴定管,草酸为酸性溶液,应该使用酸式滴定管;滴定结束前溶液为紫红色,滴定结束后变为无色,据此判断滴定终点;
(5)草酸与高锰酸根离子、氢离子发生氧化还原反应生成锰离子、二氧化碳气体和水;
(6)根据反应5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O及草酸的量计算出25mL溶液中剩余的高锰酸钾的物质的量,再计算出100ml溶液中剩余的高锰酸钾的物质的量,从而得出二氧化硫消耗的高锰酸钾的物质的量,再根据反应2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4计算出二氧化硫的物质的量,根据S原子守恒计算出样品中S的质量及质量分数.
解答:
解:(1)连接好装置,检查装置气密性的方法为:向锥形瓶中加水浸没导气管末端,关闭K,微热石英管,观察到锥形瓶中有气泡冒出,冷却后导管内形成一端稳定的气柱,
故答案为:向锥形瓶中加水浸没导气管末端,关闭K,微热石英管,观察到锥形瓶中有气泡冒出,冷却后导管内形成一端稳定的气柱;
(2)煅烧黄铁矿时需要氧气,则通入空气的目的是提供反应需要的氧气,另外通入空气后还可以将生成的二氧化硫完全赶入锥形瓶中,从而减小实验误差,
故答案为:提供反应所需O2,将生成的SO2全部赶入锥形瓶中;
(3)若实验过程中鼓入空气的速率过快,会导致部分二氧化硫没有被酸性高锰酸钾溶液吸收,则测得的硫元素的质量分数会偏低,
故答案为:偏低;
(4)草酸显示酸性,需要选用酸式滴定管盛放,即应该选用B盛放草酸溶液;滴定结束时溶液由浅紫色变为无色,则滴定终点的现象为:由浅紫色突变为无色且半分钟内不再变色,
故答案为:B;由浅紫色突变为无色且半分钟内不再变色;
(5)滴定过程中,酸性高锰酸根离子能够氧化草酸,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(6)0.23mol/L标准H2C2O4溶液21.73mL中含有草酸的物质的量为:0.23mol/L×0.02173L=0.0050mol,根据反应5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O可知,0.0050mol草酸完全反应消耗高锰酸根离子的物质的量为:0.0050mol×
=0.002mol,
原100mL滴定后的高锰酸钾溶液中含有高锰酸钾的物质的量为:0.002mol×
=0.008mol,
100mL 0.2mol/L酸性KMnO4溶液中含有高锰酸钾的物质的量为:0.2mol/L×0.1L=0.02mol,则二氧化硫消耗的高锰酸钾的物质的量为:0.02mol-0.008mol=0.012mol,根据反应2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4可知,二氧化硫的物质的量为:0.012mol×
=0.03mol,原样品中含有S的质量为:32g/mol×0.03mol=0.96g,含有硫元素的质量分数为:
×100%=48%,
故答案为:48%.
故答案为:向锥形瓶中加水浸没导气管末端,关闭K,微热石英管,观察到锥形瓶中有气泡冒出,冷却后导管内形成一端稳定的气柱;
(2)煅烧黄铁矿时需要氧气,则通入空气的目的是提供反应需要的氧气,另外通入空气后还可以将生成的二氧化硫完全赶入锥形瓶中,从而减小实验误差,
故答案为:提供反应所需O2,将生成的SO2全部赶入锥形瓶中;
(3)若实验过程中鼓入空气的速率过快,会导致部分二氧化硫没有被酸性高锰酸钾溶液吸收,则测得的硫元素的质量分数会偏低,
故答案为:偏低;
(4)草酸显示酸性,需要选用酸式滴定管盛放,即应该选用B盛放草酸溶液;滴定结束时溶液由浅紫色变为无色,则滴定终点的现象为:由浅紫色突变为无色且半分钟内不再变色,
故答案为:B;由浅紫色突变为无色且半分钟内不再变色;
(5)滴定过程中,酸性高锰酸根离子能够氧化草酸,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(6)0.23mol/L标准H2C2O4溶液21.73mL中含有草酸的物质的量为:0.23mol/L×0.02173L=0.0050mol,根据反应5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O可知,0.0050mol草酸完全反应消耗高锰酸根离子的物质的量为:0.0050mol×
| 2 |
| 5 |
原100mL滴定后的高锰酸钾溶液中含有高锰酸钾的物质的量为:0.002mol×
| 100mL |
| 25mL |
100mL 0.2mol/L酸性KMnO4溶液中含有高锰酸钾的物质的量为:0.2mol/L×0.1L=0.02mol,则二氧化硫消耗的高锰酸钾的物质的量为:0.02mol-0.008mol=0.012mol,根据反应2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4可知,二氧化硫的物质的量为:0.012mol×
| 5 |
| 2 |
| 0.96g |
| 2g |
故答案为:48%.
点评:本题考查物质组成及含量的测定方法,题目难度较大,明确测定原理为解答关键,注意掌握化学实验基本操作方法,明确中和滴定原理及操作方法,试题侧重考查学生灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )
假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )| A、假蜜环菌甲素可以发生消去反应 |
| B、1 mol假蜜环菌甲素可与 6 molH2发生加成反应 |
| C、假蜜环菌甲素可与 NaOH 溶液在加热条件下发生水解反应 |
| D、假蜜环菌甲素既能与Na反应生成H2,又能与NaHCO3反应生成CO2 |
下列推断或表述正确的是( )
| A、25℃时,pH=4.7浓度均为0.1mol?L-1的CH2COOH、CH3COONa混合溶液中,c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| B、常温下,氨水与(NH4)2SO4溶液混合所得pH=7的溶液中,c(NH4+):c(SO42-)=2:1 |
| C、将体积相同,pH均为1的盐酸和醋酸分别加水稀释至pH=3,盐酸的体积变化大,证明醋酸是弱酸 |
| D、向2.0ml浓度均为0.1mol?L-1的KCl、KI混合液中滴加1-2滴0.01mol?L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
科学家设想利用乙二醇和CO2生产可降解塑料聚碳酸酯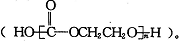 下列有关说法不正确的是( )
下列有关说法不正确的是( )
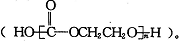 下列有关说法不正确的是( )
下列有关说法不正确的是( )| A、乙二醇可作汽车抗冻液 |
| B、减少CO2的排放可防止酸雨 |
| C、该塑料是一种有机高分子材料 |
| D、链节上酯基的水解有利于降解发生 |
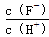 D.
D.