题目内容
用黄铜矿炼铜某工艺过程可用如图表示,试回答下列问题:
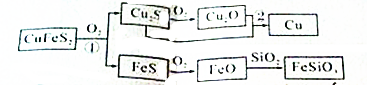
(1)写出反应①的化学方程式: ,配平总的化学反应方程式: CuFeS2+ SiO2 O2→ Cu+ FeSiO3 + SO2 .
(2)为让反应②充分进行,若不考虑物料损失,Cu2S转化为Cu2O的最佳转化率为 ,反应②中每生成1molCu,需转移 mol电子.
(3)若以精CuFeS2矿为原料在沸腾炉中和O2(空气)反应,控制温度为600℃~620℃,可生成CuSO4 和Fe2O3 ,冷却后经过溶解,除铁、结晶,得到胆矾继而精炼铜,此法中控制反应温度的办法是 ;此法中若超过控制温度,则此上述处理后胆矾产量降低,其原因是 .
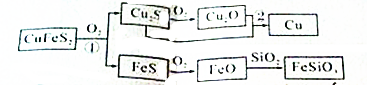
(1)写出反应①的化学方程式:
(2)为让反应②充分进行,若不考虑物料损失,Cu2S转化为Cu2O的最佳转化率为
(3)若以精CuFeS2矿为原料在沸腾炉中和O2(空气)反应,控制温度为600℃~620℃,可生成CuSO4 和Fe2O3 ,冷却后经过溶解,除铁、结晶,得到胆矾继而精炼铜,此法中控制反应温度的办法是
考点:制备实验方案的设计
专题:
分析:根据流程图知,反应①为2CuFeS2+O2
Cu2S+2FeS+SO2,从而得到Cu2S、FeS,Cu2S被氧气氧化生成Cu2O,同时生成SO2,发生反应2Cu2S+3O2
2Cu2O+2SO2,Cu2O、Cu2S反应生成Cu,反应方程式为2Cu2O+Cu2S
6Cu+SO2↑;
FeS和氧气反应生成FeO,反应方程式为2FeS+3O2
2FeO+2SO2↑,FeO和二氧化硅反应生成硅酸亚铁,反应方程式为FeO+SiO2
FeSiO3;
(1)CuFeS2+SiO2+O2→Cu+FeSiO3 +SO2 中S元素化合价由-2价变为+4价、O元素化合价由0价变为-2价,Cu元素化合价由+2价变为0价,转移电子数为24,根据转移电子守恒再结合原子守恒配平方程式;
(2)根据2Cu2O+Cu2S
6Cu+SO2↑知,Cu2O、Cu2S的物质的量之比是2:1,根据Cu原子守恒知,要使Cu2O、Cu2S恰好完全反应,Cu2S中有
生成Cu2O;根据Cu和转移电子之间的关系式计算;
(3)以精CuFeS2矿为原料在沸腾炉中和O2(空气)反应为放热反应,反应速率越小,单位时间内放出的热量越少,可以通过控制加入CuFeS2的速率控制温度;温度越高,胆矾分解生成硫酸铜,硫酸铜分解生成其它物质.
| ||
| ||
| ||
FeS和氧气反应生成FeO,反应方程式为2FeS+3O2
| ||
| ||
(1)CuFeS2+SiO2+O2→Cu+FeSiO3 +SO2 中S元素化合价由-2价变为+4价、O元素化合价由0价变为-2价,Cu元素化合价由+2价变为0价,转移电子数为24,根据转移电子守恒再结合原子守恒配平方程式;
(2)根据2Cu2O+Cu2S
| ||
| 2 |
| 3 |
(3)以精CuFeS2矿为原料在沸腾炉中和O2(空气)反应为放热反应,反应速率越小,单位时间内放出的热量越少,可以通过控制加入CuFeS2的速率控制温度;温度越高,胆矾分解生成硫酸铜,硫酸铜分解生成其它物质.
解答:
解:根据流程图知,反应①为2CuFeS2+O2
Cu2S+2FeS+SO2,从而得到Cu2S、FeS,Cu2S被氧气氧化生成Cu2O,同时生成SO2,发生反应2Cu2S+3O2
2Cu2O+2SO2,Cu2O、Cu2S反应生成Cu,反应方程式为2Cu2O+Cu2S
6Cu+SO2↑;
FeS和氧气反应生成FeO,反应方程式为2FeS+3O2
2FeO+2SO2↑,FeO和二氧化硅反应生成硅酸亚铁,反应方程式为FeO+SiO2
FeSiO3;
(1)通过以上分析知反应①为2CuFeS2+O2
Cu2S+2FeS+SO2,
CuFeS2+SiO2+O2→Cu+FeSiO3 +SO2 中S元素化合价由-2价变为+4价、O元素化合价由0价变为-2价,Cu元素化合价由+2价变为0价,转移电子数为24,根据转移电子守恒再结合原子守恒配平方程式为2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3 +4SO2 ,
故答案为:2CuFeS2+O2
Cu2S+2FeS+SO2;2;2;5;2;2;4;
(2)根据2Cu2O+Cu2S
6Cu+SO2↑知,Cu2O、Cu2S的物质的量之比是2:1,根据Cu原子守恒知,要使Cu2O、Cu2S恰好完全反应,Cu2S中有
生成Cu2O,所以Cu2S转化为Cu2O的最佳转化率为66.7%;
根据2Cu2O+Cu2S
6Cu+SO2↑Cu和转移电子之间的关系式得转移电子物质的量=1mol×6×(1-0)=6mol,
故答案为:66.7%;6;
(3)以精CuFeS2矿为原料在沸腾炉中和O2(空气)反应为放热反应,反应速率越小,单位时间内放出的热量越少,所以可以通过控制加入CuFeS2的速率控制温度;温度越高,胆矾分解生成硫酸铜,硫酸铜分解生成其它物质,从而导致胆矾的产量降低,
故答案为:控制加入CuFeS2的速度(原因:CuFeS2与O2反应放热);生成的CuSO4发生了分解生成铜的其它化合物.
| ||
| ||
| ||
FeS和氧气反应生成FeO,反应方程式为2FeS+3O2
| ||
| ||
(1)通过以上分析知反应①为2CuFeS2+O2
| ||
CuFeS2+SiO2+O2→Cu+FeSiO3 +SO2 中S元素化合价由-2价变为+4价、O元素化合价由0价变为-2价,Cu元素化合价由+2价变为0价,转移电子数为24,根据转移电子守恒再结合原子守恒配平方程式为2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3 +4SO2 ,
故答案为:2CuFeS2+O2
| ||
(2)根据2Cu2O+Cu2S
| ||
| 2 |
| 3 |
根据2Cu2O+Cu2S
| ||
故答案为:66.7%;6;
(3)以精CuFeS2矿为原料在沸腾炉中和O2(空气)反应为放热反应,反应速率越小,单位时间内放出的热量越少,所以可以通过控制加入CuFeS2的速率控制温度;温度越高,胆矾分解生成硫酸铜,硫酸铜分解生成其它物质,从而导致胆矾的产量降低,
故答案为:控制加入CuFeS2的速度(原因:CuFeS2与O2反应放热);生成的CuSO4发生了分解生成铜的其它化合物.
点评:本题制备实验方案设计,侧重考查学生整体分析、推断及知识运用能力,涉及氧化还原反应配平、计算、反应速率影响因素等知识点,明确流程图中每一步发生的反应,题目难度中等.

练习册系列答案
相关题目
某硫酸厂废气中SO2的回收利用方案如图所示.下列说法错误的是( )


| A、X可能含有2种盐 |
| B、Y可能含有(NH4)2SO4 |
| C、a是SO3 |
| D、(NH4)2S2O8中S的化合价不可能为+7 |
 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )| A、Z的氧化物可与Y的氢化物水溶液发生化学反应 |
| B、X的原子半径比As原子半径小,两者原子序数之差为29 |
| C、W的氧化物对应的水化物是共价化合物,并且必是强酸 |
| D、图中五种元素均是非金属元素,并且Y的非金属性最强 |
下列说法不正确的是( )
| A、淀粉和纤维素均为高分子化合物,两者都是工业制造酒精的原料 |
| B、CH2=CH-CH(CH3)-C≡CH经催化加氢可生成3-甲基戊烷 |
| C、等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减少 |
D、已知苹果酸的结构简式为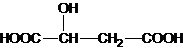 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 |
 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。