题目内容
标准状况下,2.24LCO和CO2混合气体中含有的C原子数为0.1NA. (判断对错)
考点:物质的量的相关计算
专题:计算题
分析:由n=
、N=nNA分析.
| V |
| Vm |
解答:
解:标准状况下,Vm=22.4L/mol,则2.24LCO和CO2混合气体的物质的量为
=0.1mol,
n(C)=0.1mol,所以C原子数为0.1NA,说法正确,
故答案为:对.
| 2.24L |
| 22.4L/mol |
n(C)=0.1mol,所以C原子数为0.1NA,说法正确,
故答案为:对.
点评:本题考查物质的量的计算,为高频考点,把握物质的构成及物质的量与体积的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下表所列各组物质中,物质之间按箭头方向通过一步反应不能实现如图所示转化的是( )
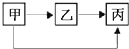

| 物质 选项 | 甲 | 乙 | 丙 |
| A | CuO | CO2 | H2O |
| B | C | CO | CO2 |
| C | CaCO3 | CaO | Ca(OH)2 |
| D | H2SO4 | H2O | H2 |
| A、A | B、B | C、C | D、D |
在常温下,PH=a的醋酸和PH=14-a的NaOH溶液等体积混合,所得溶液的下列说法正确的是( )
| A、PH<7 |
| B、PH=7 |
| C、PH>7 |
| D、上述三种均有可能 |
已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.30×10-5mol/L.若在5mL含有KCl和KI浓度均为0.01mol/L的混合溶液中,滴加8mL 0.01mol/L的AgNO3溶液,则下列叙述中不正确的是A( )
| A、反应后溶液中离子浓度大小关系为:c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B、发生反应生成的AgI沉淀多于AgCl沉淀 |
| C、在水中AgCl的溶解度比AgI的溶解度大 |
| D、若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
