题目内容
9.已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关,当n(NaOH)=a mol时,下列有关说法错误的是( )| A. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| B. | 改变温度,产物中NaClO3的最大理论产量为$\frac{1}{7}$amol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:$\frac{1}{2}$amol≤n≤$\frac{5}{6}$amol | |
| D. | 某温度下,若反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(C{l}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{11}{2}$ |
分析 A.依据方程式:2NaOH+Cl2═NaCl+NaClO+H2O,计算判断;
B.据发生6NaOH+3Cl2═5NaCl+NaClO3+3H2O,进行分析;
C.用极值法,分别设氢氧化钠与氯气全部发生:2NaOH+Cl2═NaCl+NaClO+H2O和6NaOH+3Cl2═5NaCl+NaClO3+3H2O,据方程式计算生成氯化钠的物质的量;
D.依据氧化还原反应得失电子守恒计算.
解答 解:A.常温时;2NaOH+Cl2═NaCl+NaClO+H2O,反应2mol氢氧化钠,消耗1mol氯气,所以Cl2通入amol NaOH溶液恰好完全反应,则参加反应的氯气的物质的量等于0.5a mo1,故A正确;
B.6NaOH+3Cl2═5NaCl+NaClO3+3H2O
6 1
a $\frac{1}{6}$a>$\frac{1}{7}$a,故B错误;
C.当只发生6NaOH+3Cl2═5NaCl+NaClO3+3H2O,转移电子数最多,依据方程式6mol氢氧化钠反应转移5mol电子,所以amol氢氧化钠反应,最多转移$\frac{5a}{6}$mol电子,若只发生反应2NaOH+Cl2═NaCl+NaClO+H2O,转移电子数最少,依据方程式2mol氢氧化钠反应转移1mol电子,所以amol氢氧化钠反应,最少转移$\frac{1}{2}a$mol电子,故转移电子的物质的量n的范围$\frac{1}{2}$amol≤n≤$\frac{5}{6}$amol,故C正确;
D.反应中氯气一部分化合价升高生成次氯酸钠、氯酸钠,一部分化合价降低生成氯化钠,依据得失电子守恒可知:C(ClO-)×1+5×C(ClO3-)=C(Cl-)×1,左右两边同时除以C(ClO-)得,$\frac{C(ClO-)×1+5×C(Cl{O}_{3}-)}{C(ClO-)}$=$\frac{C(Cl-)×1}{C(ClO-)}$,整理得,1+5$\frac{C(Cl{O}_{3}-)}{C(ClO-)}$=11,故$\frac{C(Cl{O}_{3}-)}{C(ClO-)}$=2,假设C(ClO3-)=2mol/L,则C(ClO-)=1mol/L,C(Cl-)=11mol/L,则$\frac{c(C{l}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{11}{2}$,故D正确;
故选B.
点评 本题考查氯气氯气与氢氧化钠溶液的反应,明确氧化还原反应得失电子守恒是解题关键,注意反应条件对反应的影响,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
下列有关说法正确的是( )
| A. | 图1中b点对应的平衡常数K值大于c点 | |
| B. | 图1中a点对应的H2的转化率等于30% | |
| C. | 图2中电极M上发生还原反应 | |
| D. | 图2中电极N的反应式:H2O2+2e-+6H+=2H2O |
| A. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| B. | 利用CO2合成聚碳酸酯类可降解塑料,有利于减少白色污染 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 我国汽油标准由“国III”提高到“国1V”,目的是减少有害气体的排放,改善环境质量 |
| A. | 1molN2中含有的分子数为2×6.02×1023 | |
| B. | 用激光笔照射CuSO4溶液可产生“丁达尔效应” | |
| C. | 常温下,铝片能溶于浓硫酸 | |
| D. | 常温下,淀粉溶液遇I2变为蓝色 |
 常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | A可能表示Na+ | |
| B. | A可能表示乙酸分子 | |
| C. | 若图中A表示CH3COO-,可以证明乙酸是弱酸 | |
| D. | 该混合溶液中:c(A)+c(Y)=c(X)+c(Z) |
| A. | 乙醇通过消去反应可制得乙烯 | |
| B. | CH3CH=CHCH3分子中的4个碳原子在同一平面上 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| D. | 在溴水中加入苯,振荡后溴水的颜色变浅,这是由于发生了加成反应 |
| A. | 100g 98%的浓硫酸中含有的氢原子数目为2NA | |
| B. | 16g16O2和18O2的混合物中含有的质子数目为8NA | |
| C. | 电解精炼铜的过程中,若阳极减重64g,则电路中一定通过2NA个电子 | |
| D. | 取50ml14.0mol/L浓硝酸与足量的铜片反应,生成气体分子的数目可能为0.25NA |
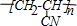 .
.