题目内容
6.设NA为阿伏加德罗常数的数值,下列说法错误的是( )| A. | 32g SO2所含的原子数目为1.5NA | |
| B. | 0.5molCH4含有的原子数目为2.5N:x | |
| C. | 10g H2O含有的水分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
分析 A、求出二氧化硫的物质的量,然后根据1mol二氧化硫中含3mol原子来分析;
B、甲烷为5原子分子;
C、分子数N=$\frac{m}{M}{N}_{A}$来计算;
D、根据物质的量n=$\frac{N}{{N}_{A}}$来计算.
解答 解:A、32g二氧化硫的物质的量n=$\frac{32g}{64g/mol}$=0.5mol,而1mol二氧化硫中含3mol原子,故0.5mol二氧化硫中含1.5NA个原子,故A正确;
B、甲烷为5原子分子,故0.5mol甲烷中含2.5mol原子即2.5NA个,故B正确;
C、分子数N=$\frac{m}{M}{N}_{A}$=$\frac{10g}{18g/mol}$×NA/mol=0.56NA个,故C错误;
D、物质的量n=$\frac{N}{{N}_{A}}$=$\frac{0.5{N}_{A}}{{N}_{A}}$=0.5mol,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,根据公式的运用和物质的结构来分析计算,难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
4.下列实验所对应的装置或所选用的物品都准确的是( )
| A. | 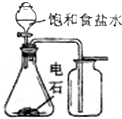 实验室制备并收集乙炔 | B. | 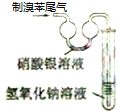 证明溴苯中含溴元素 | ||
| C. | 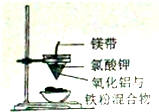 铝热反应 | D. | 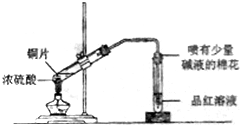 检测铜与浓硫酸反应的气体产物 |
14.下列条件下,两种气体的分子数一定不相等的是( )
| A. | 相同体积、相同密度的CO和C2H4 | |
| B. | 相同质量、不同密度的N2和C2H4 | |
| C. | 相同压强、相同体积、相同质量的O2和N2 | |
| D. | 相同温度、相同压强、相同体积的O2和N2 |
18.在一密闭容器中,反应m A(g)+n B(?)?3C(g)达到平衡时,测得c(A)=0.5mol/L.在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25mol/L.下列判断中正确的是( )
| A. | B一定为固体 | B. | 平衡向右移动 | ||
| C. | 化学计量数:m+n大于或等于3 | D. | 物质C的体积分数减小 |
16.恒温条件下,将NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O4(g),△H<0达到平衡后,慢慢压缩气体体积,下列叙述正确的是( )
| A. | 若体积减小一半,则压强为原来的两倍 | |
| B. | 平衡向右移动,混合气体颜色一定会变浅 | |
| C. | 若体积减小一半,压强增大,达到原来的两倍 | |
| D. | 平衡向右移动,混合气体密度增大 |