题目内容
1.下列物质能促进水的电离的是( )| A. | HCl | B. | CH3COONa | C. | NaOH | D. | NaCl |
分析 水为弱电解质,能够电解出氢离子和氢氧根离子,在溶液中存在电离平衡;加入酸溶液和碱溶液能够抑制水的电离,加入能够水解的盐促进了水的电离,据此进行判断.
解答 解:A.加入盐酸,溶液中氢离子浓度增大,水的电离平衡向着逆向移动,抑制了水的电离,故A错误;
B.加入醋酸钠,醋酸根根离子结合水电离的氢离子,水的电离程度增大,醋酸钠促进了水的电离,故B正确;
C.加入氢氧化钠为强碱,溶液中氢氧根离子浓度增大,水的电离平衡逆向进行,抑制了水的电离,故C错误;
D.加入氯化钠是强酸强碱盐,钠离子和氯离子都不影响水的电离,故D错误;
故选B.
点评 本题考查了水的电离及其影响因素,题目难度不大,注意掌握水的电离及影响,明确酸碱溶液抑制水的电离,含有弱酸根或者弱碱根离子的盐能够促进水的电离.

练习册系列答案
相关题目
6.下列水解方程式的书写中,正确的是( )
| A. | CH3COO-的水解方程式:CH3COO-+H2O?CH3COOH+OH- | |
| B. | HCO3-的水解方程式:HCO3-+H2O?CO32-+H3O+ | |
| C. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- | |
| D. | Fe3+的水解方程式:Fe3++3OH-?Fe(OH)3 |
11.某化学兴趣小组的成员捡到一块矿石,观察外观发现该矿石坚硬且呈红褐色,投入水中没有任何变化,再向水中加浓盐酸至过量,矿石部分溶解,并有大量无色气体生成.学生猜测该矿石可能由CaCO3、SiO2、Fe2O3三种成分组成,试设计实验证明CaCO3以外的两种成分.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗、漏斗架;2 mol•L-1盐酸、2mol•L-1NaOH溶液、2%的KSCN溶液.
(1)将实验方案用以下流程示意图表示,试写出每步所用试剂的名称或化学式.
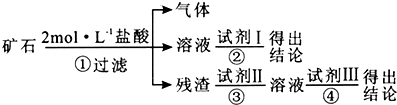
试剂Ⅰ2%的KSCN溶液;试剂Ⅱ2mol•L-1NaOH溶液;试剂Ⅲ2mol•L-1盐酸.
(2)如果猜测是成立的,试根据上述实验方案,叙述实验操作,预期现象和结论.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗、漏斗架;2 mol•L-1盐酸、2mol•L-1NaOH溶液、2%的KSCN溶液.
(1)将实验方案用以下流程示意图表示,试写出每步所用试剂的名称或化学式.

试剂Ⅰ2%的KSCN溶液;试剂Ⅱ2mol•L-1NaOH溶液;试剂Ⅲ2mol•L-1盐酸.
(2)如果猜测是成立的,试根据上述实验方案,叙述实验操作,预期现象和结论.
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取适量矿石研细,加 足量2 mol•L-1盐酸 | 有大量无色气体生成,得棕黄 色溶液,且仍有少量固体残留 |
| ② | ||
| ③ | ||
| ④ |
 实验室用氯化钠固体配制1.00mol/L的NaCl溶液100mL,回答下列问题:
实验室用氯化钠固体配制1.00mol/L的NaCl溶液100mL,回答下列问题: 铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题: .
.


 工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系.其中直线表示反应的理论值;曲线表示生产实际情况.当氨氧化率达到100%,理论上r$\frac{n({O}_{2})}{n(N{H}_{3})}$=1.25,实际生产要将r值维持在1.7~2.2之间,原因是O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%.
工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系.其中直线表示反应的理论值;曲线表示生产实际情况.当氨氧化率达到100%,理论上r$\frac{n({O}_{2})}{n(N{H}_{3})}$=1.25,实际生产要将r值维持在1.7~2.2之间,原因是O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%.