题目内容
4.碳与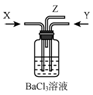 浓硫酸共热产生的气体X和铜和浓硝酸反应产生的气体Y间时通入盛有足量氯化钡溶液的气瓶中(如图装置),下列有关说法不正确的是( )
浓硫酸共热产生的气体X和铜和浓硝酸反应产生的气体Y间时通入盛有足量氯化钡溶液的气瓶中(如图装置),下列有关说法不正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | B. | 洗气瓶中产生的沉淀是亚硫酸钡 | ||
| C. | 洗气瓶中有氧化还原反应发生 | D. | 在Z导管口有红棕色气体出现 |
分析 碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,同时通入时因NO2与水和SO2共同作用要产生SO42-和NO,NO在空气中又会生成NO2,以此解答该题.
解答 解:碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,
洗气瓶中发生SO2+H2O+NO2=H2SO4+NO这梓的氧化还原反应,故洗气瓶中产生的是硫酸钡沉淀,Z处逸出的气体中有CO2和NO,NO遇到空气中的氧气生成了红棕色的NO2.
故选AB.
点评 本题考查硝酸、浓硫酸的性质以及二氧化硫与二氧化氮等物质的性质题目难度不大,注意相关元素化合物知识的积累.

练习册系列答案
相关题目
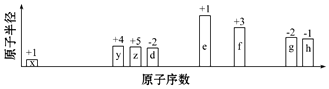
19.碱金属是典型的活泼金属,其根本原因是( )
| A. | 碱金属原子最外电子层上都只有1个电子,容易失去 | |
| B. | 碱金属在常温下易被氧化 | |
| C. | 碱金属单质的密度小,熔点和沸点低 | |
| D. | 碱金属原子的核电荷数比较小 |
20.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | F-离子结构示意图 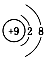 | ||
| C. | 次氯酸电子式  | D. | 用电子式表示HCl形成过程 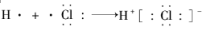 |
9.苯是一种重要的有机化工原料,广泛用于合成橡胶、塑料和医药等方面.下列关于苯的叙述正确的是( )
| A. | 分子式为C6H6 | B. | 属于不饱和烃 | C. | 能在空气中燃烧 | D. | 无色无毒的液体 |
13.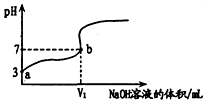 常温下,用0.1000mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程溶液pH随NaOH溶液的体积的变化曲线如图所示(忽略中和热效应).下列说法不正确的是( )
常温下,用0.1000mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程溶液pH随NaOH溶液的体积的变化曲线如图所示(忽略中和热效应).下列说法不正确的是( )
 常温下,用0.1000mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程溶液pH随NaOH溶液的体积的变化曲线如图所示(忽略中和热效应).下列说法不正确的是( )
常温下,用0.1000mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程溶液pH随NaOH溶液的体积的变化曲线如图所示(忽略中和热效应).下列说法不正确的是( )| A. | 常温下,HA的电离常数K(HA)约为10-5 | |
| B. | v1<20 | |
| C. | 溶液中水的电离程度:a点>b点 | |
| D. | 滴定过程为了确定滴定终点,最合适的指示剂是酚酞 |
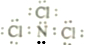 .
.



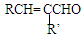 +H2O
+H2O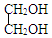 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$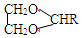 +H2O
+H2O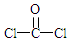 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$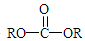 +2HCl
+2HCl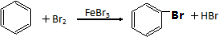 .
.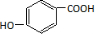 .
.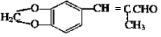 .
.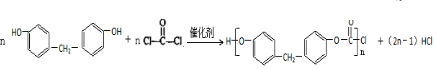 .
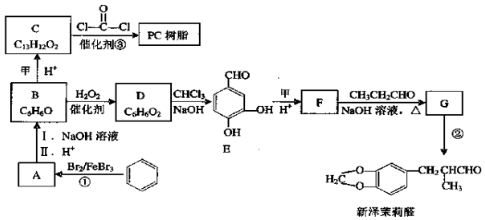
.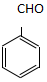 )为原料,选用必要的无机试剂合成
)为原料,选用必要的无机试剂合成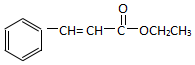 ,写出合成路线
,写出合成路线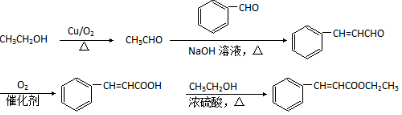 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).