题目内容
已知可逆反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ?mo1-l. 若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:由4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-1025kJ/mol知,该反应是一个反应前后气体体积增大的放热反应,升高温度,化学平衡向吸热方向移动,增大压强平衡向气体体积减小的方向移动,催化剂能改变化学反应速率但不影响化学平衡.
解答:
解:A、该反应是一个反应前后气体体积增大的放热反应,升高温度,平衡向逆反应方向移动,导致一氧化氮的含量减少,故A正确;
B、该反应是一个反应前后气体体积增大的放热反应,增大压强平衡向逆反应方向移动,导致一氧化氮的含量减少,故B正确;
C、催化剂能改变化学反应速率但不影响化学平衡,正催化剂能加快反应速率缩短反应到达平衡的时间,故C正确;
D、该反应是一个反应前后气体体积增大的放热反应,升高温度,平衡向逆反应方向移动,导致一氧化氮的含量减少,故D错误;
故选D.
B、该反应是一个反应前后气体体积增大的放热反应,增大压强平衡向逆反应方向移动,导致一氧化氮的含量减少,故B正确;
C、催化剂能改变化学反应速率但不影响化学平衡,正催化剂能加快反应速率缩短反应到达平衡的时间,故C正确;
D、该反应是一个反应前后气体体积增大的放热反应,升高温度,平衡向逆反应方向移动,导致一氧化氮的含量减少,故D错误;
故选D.
点评:本题以图象为载体考查了外界条件对化学平衡的影响,难度不大,明确催化剂能改变化学反应速率但不影响化学平衡.

练习册系列答案
相关题目
将NaClO3和Na2SO3按物质的量比2:1加入烧瓶中,再滴入少量稀硫酸并加热,产生棕黄色气体X,反应后测得恰好完全反应,则X为( )
| A、ClO2 |
| B、Cl2O3 |
| C、Cl2O |
| D、Cl2 |
氯在自然界以化合物形态存在,18世纪70年代,首先发现并制得氯气的化学家是( )
| A、道尔顿 | B、舍勒 |
| C、阿伏加德罗 | D、玻尔 |
在一个固定容积的密闭容器中发生可逆反应:2A(g)+B(g)?3C(g)+D(s),不能说明达到平衡状态的标志是( )
| A、体系的压强不再改变 |
| B、混合气体密度不再改变 |
| C、反应速率3υA(正)=2υC(逆) |
| D、混合气体平均相对分子质量不再改变 |
我国发射的“神舟五号”载人飞船的燃料是铝粉与高氯酸铵的混合物.点燃时,铝粉氧化放热引发高氯酸铵反应2NH4ClO4=N2↑+4H2O+Cl2↑+O2↑;△H<0.关于该反应叙述不正确的是( )
| A、该反应属于分解反应、氧化还原反应、放热反应 |
| B、该反应瞬间能产生大量高温气体,推动飞船飞行 |
| C、从能量变化上看,该反应是化学能转变为热能和动能 |
| D、反应中NH4ClO4只起到氧化剂的作用 |
下列说法正确的是( )
| A、要实现Fe2+→Fe3+的转化,必须加入还原剂 |
| B、在反应CaH2+2H2O═Ca(OH)2+2H2↑,水作氧化剂 |
| C、反应2H2S+SO2═3S+2H2O中氧化剂和还原剂的物质的量之比是2:1 |
| D、因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2 NaClO3═2NaIO3+Cl2不能发生 |
制取相同物质的量的硝酸铜,消耗硝酸物质的量最多的反应是( )
| A、铜和浓硝酸 |
| B、铜和稀硝酸 |
| C、氧化铜和浓硝酸 |
| D、氧化铜和稀硝酸 |
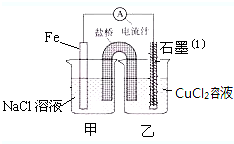 某实验小组的同学对电化学原理进行了一系列探究活动
某实验小组的同学对电化学原理进行了一系列探究活动