题目内容
16.下列反应的离子方程式书写正确的是( )| A. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 氢氧化钡溶液与稀H2SO4 反应:H++SO42-+Ba2++OH-=H2O+BaSO4↓ | |
| C. | 纯碱与醋酸溶液反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 氧化铜溶于稀硫酸:CuO+2H+=Cu2++H2O |
分析 A.反应生成硫酸亚铁和氢气;
B.不符合离子的配比;
C.醋酸在离子反应中保留化学式;
D.反应生成硫酸铜和水.
解答 解:A.稀 H2SO4与铁粉反应的离子反应为Fe+2H+=Fe2++H2↑,故A错误;
B.氢氧化钡溶液与稀H2SO4 反应的离子反应为2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,故B错误;
C.纯碱与醋酸溶液反应的离子反应为CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑,故C错误;
D.氧化铜溶于稀硫酸的离子反应为CuO+2H+=Cu2++H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
6.AlPO4的沉淀溶解平衡曲线如图所示(T2>T1).下列说法正确的是( )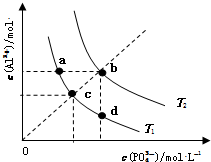

| A. | 图象中四个点的Ksp:a=b>c>d | B. | AlPO4在b点对应的溶解度大于c点 | ||
| C. | AlPO4(s)?Al3+(aq)+PO43-(aq)△H<0 | D. | 升高温度可使d点移动到b点 |
7.从碘水中萃取碘,能够选用的试剂是( )
| A. | 乙醇 | B. | 盐酸 | C. | 醋酸 | D. | 四氯化碳 |
4.下列离子方程式正确的是( )
| A. | 铁和硝酸银溶液反应 Cu+Ag+=Ag+Cu2+ | |
| B. | 氢氧化铝与硫酸溶液反应 OH-+H+=H2O | |
| C. | 碳酸钙与醋酸溶液反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 铁与稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ |
11.关于物质的类别,下列说法正确的是( )
| A. | 食盐水、糖水和冰水都是饮料,属于混合物 | |
| B. | O2不能导电,故O2是非电解质 | |
| C. | 烧碱属于碱,纯碱属于盐 | |
| D. | NaHSO4能电离出氢离子,故NaHSO4属于酸 |
5.若溶液中由水电离产生的C(OH-)=1.0×1013mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | Na+、Fe2+、NO3-、Cl- | B. | Na+、K+、NO3-、Cl- | ||
| C. | Na+、K+、AlO2-、Cl- | D. | NH4+、K+、SO42-、HCO3- |