题目内容
9.氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化.
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
则SO2气体与NO2气体反应生成SO3气体和NO气体的反应为放热(填“放热”或“吸热”)反应.
(2)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图1所示.
①反应在c点未达(填“达到”或“未到”)平衡状态.
②开始时,在该容器中加入:
Ⅰ:1molSO2(g)和1molNO2(g);
II:1molSO3(g)和1mol NO(g),
则达化学平衡时,该反应的平衡常数Ⅰ<Ⅱ(填“>”、“=”或“<”).
(3)用氢氧化钠溶液吸收氮的氧化物时发生下列反应:
2NaOH+NO+NO2?2NaNO2+H2O
2NaOH+2NO2?NaNO2+NaNO2+H2O
将反应混合液和氢氧化钠溶液分别加到如图2所示的电解槽中进行电解,A室产生了N2.
①电极Ⅰ是阴极,B室产生的气体是O2.
②A室NO2-发生的电极反应是2NO2-+6e-+6H2O=8OH-+N2↑.
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.现有NO、NO2的混合气6L,可用同温同压下7L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为1:3.
分析 (1)根据所给的条件反应,结合要求的目标反应,将条件反应调整计量数并做相应的加减得目标反应,反应热做相应的变化即可;
(2)①反应达平衡的根本标志是V正=V逆,而c点的只是V正最大而已;
②容器恒容绝热,SO2(g)+NO2(g)?NO(g)+SO3 (g)△H<0,反应放热,若在该容器中加入:Ⅰ:1molSO2(g)和1molNO2(g),则开始反应放热;若在容器中加入II:1molSO3(g)和1mol NO(g),则开始时反应吸热,据此分析平衡常数;
(3)通过A室产生了N2,可知A极的电解质溶液为NaNO3和NaNO2的混合溶液,NO2-在A极放电为N2,则A为阴极;则B极为阳极,电解质溶液为NaOH溶液,OH-在B极放电,据此分析;
(4)设出NO的体积为XL,NO2的体积为YL,则有X+Y=6 ①然后根据和氨气反应时得失电子数守恒可有:2X+4Y=7×3 ②将两式联立解答.
解答 解:(1)已知:2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ•mol-1 ①
2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ•mol-1 ②
根据盖斯定律,将$\frac{1}{2}$(①-②)可得:SO2(g)+NO2(g)?NO(g)+SO3 (g)△H=$\frac{1}{2}$[(-196.6kJ•mol-1)-(-113.0kJ•mol-1)]=-41.6KJ/mol,该反应的焓变△H<0,为放热反应,
故答案为:放热;
(2)①化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故一定未达平衡,
故答案为:未达;
②容器恒容绝热,SO2(g)+NO2(g)?NO(g)+SO3 (g)△H<0,反应放热,若在该容器中加入:Ⅰ:1molSO2(g)和1molNO2(g),则开始反应放热,温度升高平衡左移,K减小;若在容器中加入II:1molSO3(g)和1mol NO(g),则开始时反应吸热,温度降低平衡右移,K增大,故该反应的平衡常数Ⅰ<Ⅱ,
故答案为:<;
(3)通过A室产生了N2,可知I极的电解质溶液为NaNO3和NaNO2的混合溶液,NO2-在I放电为N2,则A为阴极;则II极为阳极,电解质溶液为NaOH溶液,OH-在II极放电.
①电极I为阴极,由于B室为NaOH溶液,且II极为阳极,故在II极放电的是氢氧根:4OH--4e-=O2↑+2H2O,即产生的气体为氧气,
故答案为:阴极;O2;
②NO2-在阴极得电子被还原为氮气,结合B室的溶液是中性溶液,故放电的方程式为:2NO2-+6e-+6H2O=8OH-+N2↑,
故答案为:2NO2-+6e-+6H2O=8OH-+N2↑;
(4)设出NO的体积为XL,NO2的体积为YL,根据混合气体的体积为6L,则有X+Y=6 ①
氨气反应时,NO和NO2得电子,而氨气失电子,根据得失电子数守恒可有:2X+4Y=7×3 ②
将两式联立即可解得X=1.5,Y=4.5,则有X:Y=1:3,
故答案为:1:3.
点评 本题考查较为综合,涉及本题考查了盖斯定律的应用、化学平衡常数的大小比较以及电化学知识的运用,注意掌握盖斯定律的内容、电解原理,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力.

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案| A. | 植物油存放过久,会有一种难闻的“哈喇”味,但不影响食用 | |
| B. | 葡萄糖能发生水解反应 | |
| C. | 淀粉和纤维素水解的最终产物是葡萄糖 | |
| D. | 氨基酸分子中含有氨基和羧基,因此具有两性,但蛋白质没有两性 |
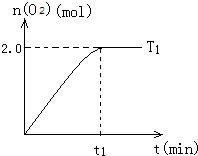 一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1温度下不同时段产生O2的量,见表:
一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1温度下不同时段产生O2的量,见表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
(2)T1温度下,该反应的平衡常数表达式为:K=$\frac{{c}^{2}({H}_{2})×c({O}_{2})}{{c}^{2}({H}_{2}O)}$
(3)在T2温度时,K=0.4,T1> T2(填“>”“<”“=”)
(4)T1温度下,t1时刻达到平衡时的图象大致为:(见图I)
请在图I中画出降温至T0后,t0min达到平衡时的大致图象,并作必要的简单标注.
(5)H2可作氢氧燃料电池的反应物质,请写出在酸性介质中,氢氧燃料电池的负极反应式:H2-2e-=2H+.
 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式K=$\frac{[CH{\;}_{3}OCH{\;}_{3}]•[H{\;}_{2}O]{\;}^{3}}{[CO{\;}_{2}]{\;}^{2}•[H{\;}_{2}]{\;}^{6}}$.
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是BD.
A.容器中密度不变
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3
D.容器内压强保持不变
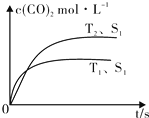
(2)汽车尾气净化的主要原理为:2NO(g)+2CO (g) $\stackrel{催化剂}{?}$2CO2 (g)+N2 (g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(3)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |

【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+HCl↑
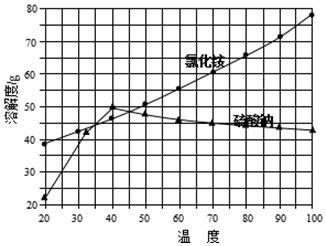
②氯化铵和硫酸钠的溶解度随温度变化曲线如图所示:
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式:(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4.
(2)欲制备10.7g NH4Cl,理论上需NaCl质量为11.7g.
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有玻璃棒、烧杯、蒸发皿.
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为35℃.
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
| 操作步骤 | 现象 | 结论 |
| 取少量氯化铵产品于试管底部,加热 | 如果试管底部没有固体剩余 | 表明氯化铵产品纯净 |
 麻黄素中含氧官能团的名称是羟基,属于醇类(填“醇”或“酚”).
麻黄素中含氧官能团的名称是羟基,属于醇类(填“醇”或“酚”). 化工工业中常用乙苯脱氢的方法制备苯乙烯.
化工工业中常用乙苯脱氢的方法制备苯乙烯. (g)→
(g)→ (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol