题目内容
4.已知下述反应:3Cl2+8NH3═6NH4Cl+N2,发生化学反应的氯气和氨的分子数之比是3:8,氧化剂和还原剂的分子数之比是3:2,用双线桥表示电子转移的方向和数目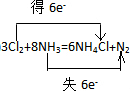 .
.
分析 8NH3+3Cl2═6NH4Cl+N2中,N元素的化合价由-3价升高为0,Cl元素的化合价由0降低为-1价,以此来解答.
解答 解:8NH3+3Cl2═6NH4Cl+N2中,发生化学反应的氯气和氨的分子数之比是3:8;Cl元素的化合价降低,则Cl2为氧化剂,N元素的化合价升高,还原剂为NH3,氧化剂和还原剂的分子数之比=3:8×$\frac{1}{4}$=3:2;
反应中N元素的化合价由-3升高为0,Cl元素的化合价0降低为-1价,2molNH3作还原剂转移电子为6mol,则反应电子转移的方向和数目为 ,故答案为:3:8;3:2;
,故答案为:3:8;3:2; .
.
点评 本题考查氧化还原反应,把握发生的化学反应及反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
14.下列分散系属于胶体的是( )
| A. | FeCl3溶液 | B. | CuSO4溶液 | C. | 碘酒 | D. | 有色玻璃 |
19.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 16g CH4与18g NH4+所含的质子数均为10NA | |
| B. | 将15.6g Na2O2投入到足量水中,反应后溶液中的氧原子数为0.4NA | |
| C. | 在1L 0.1 mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.lNA | |
| D. | 2molNO和1 mol O2混合,所得气体的分子数为2NA |
9.在体积恒定的密闭容器中,一定量的SO2与1.25mol O2在催化剂作用下加热到600℃发生反应:2SO2(g)+O2(g) $?_{加热}^{催化剂}$2SO3(g)△H<0.当气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%.下列有关叙述正确的是( )
| A. | 该温度下的平衡常数为101.25 L/moL | |
| B. | 达到平衡时,SO2的转化率是90% | |
| C. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| D. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为231.4g |
16.有机物M的分子式为C6 H10O4,且1mol M与足量NaHCO3溶液反应会生成2mol气体,则M的结构(不包括立体异构)可能有( )
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
13.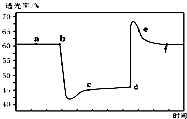 已知反应:2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H<0.将一定量的NO2与CO充入装有催化剂的注射器中后封口.右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法不正确的是( )
已知反应:2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H<0.将一定量的NO2与CO充入装有催化剂的注射器中后封口.右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法不正确的是( )
 已知反应:2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H<0.将一定量的NO2与CO充入装有催化剂的注射器中后封口.右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法不正确的是( )
已知反应:2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H<0.将一定量的NO2与CO充入装有催化剂的注射器中后封口.右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法不正确的是( )| A. | b点的操作是快速压缩注射器 | |
| B. | c点与a点相比,c(NO2)、c(N2)都增大 | |
| C. | e点:υ(正)<υ(逆) | |
| D. | 若考虑体系温度变化,且没有能量损失,则平衡常数K(c)>K(f) |
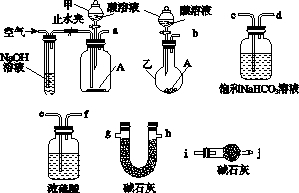 碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:
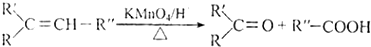
 .
. .
.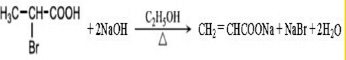 .
. ,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).
,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).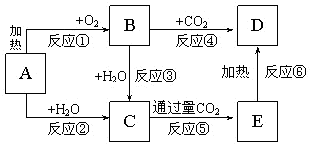 如图所示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
如图所示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.