题目内容
下列关于物质用途的叙述中,错误的是( )
| A、明矾溶于水形成的Al(0H)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、用氧化铝坩埚加热熔化氢氧化钠固体 |
| C、二氧化硅可以用于制造光导纤维 |
| D、硅用作太阳能电池材料 |
考点:盐类水解的应用,硅和二氧化硅,镁、铝的重要化合物
专题:化学应用
分析:A.胶体表面积大具有吸附作用;
B.氧化铝与氢氧化钠能反应;
C.二氧化硅晶体具有导光性;
D.硅单质是重要半导体材料,能用于制太阳能电池.
B.氧化铝与氢氧化钠能反应;
C.二氧化硅晶体具有导光性;
D.硅单质是重要半导体材料,能用于制太阳能电池.
解答:
解:A.明矾溶于水形成的Al(0H)3胶体,氢氧化铝胶体具有很大的表面积,具有吸附作用,能吸附水中悬浮物,可用于水的净化,故A正确;
B.氧化铝与氢氧化钠能反应生成偏铝酸钠和水,所以不能用氧化铝坩埚加热熔化氢氧化钠固体,故B错误;
C.二氧化硅晶体具有导光性,所以二氧化硅可以用于制造光导纤维,故C正确;
D.硅单质是重要半导体材料,能用于制太阳能电池,故D正确;
故选B.
B.氧化铝与氢氧化钠能反应生成偏铝酸钠和水,所以不能用氧化铝坩埚加热熔化氢氧化钠固体,故B错误;
C.二氧化硅晶体具有导光性,所以二氧化硅可以用于制造光导纤维,故C正确;
D.硅单质是重要半导体材料,能用于制太阳能电池,故D正确;
故选B.
点评:本题考查了明矾的净水原理、氧化铝与氢氧化钠的反应、硅及其化合物的性质及用途,属于基础知识的考查,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
下列离子方程式中正确的是( )
| A、碳酸钡和稀盐酸反应:CO32-+2H+═H2O+CO2↑ |
| B、钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ |
| C、将CO2气体通入澄清石灰水中:CO2+Ca(OH)2═CaCO3↓+H2O |
| D、H2SO4与Ba(OH)2溶液反应:Ba2++OH+H++SO42-═BaSO4↓+H2O |
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
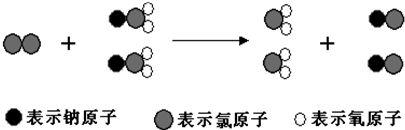
下列有关叙述中正确的是( )

下列有关叙述中正确的是( )
| A、该反应是复分解反应 |
| B、ClO2 的消毒效率(等质量时得到电子的多少)是Cl2 的2.63倍 |
| C、反应中Cl2既是氧化剂,又是还原剂 |
| D、生成2mol ClO2时转移的电子数为6mol |
下列实验操作或结论表述正确的是( )
| A、纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度快一些 |
| B、判断CuO和MnO2对H2O2分解的催化效率,可通过比较H2O2溶液析出气泡的快慢程度,或测定单位时间内产生氧气的体积 |
| C、食醋总酸含量测定实验中,实验结束时碱式滴定管尖嘴部位有气泡,则测定的醋酸含量偏高 |
| D、将硫酸亚铁和硫酸铵的混合溶液加热浓缩,冷却结晶后可析出摩尔盐粗产品,再用酒精洗去晶体表面的水分,加热烘干后称重,计算产率 |
将含有KCl,CuBr2,Na2SO4 三种物质的水溶液(分别为1mol/L)用铂电极进行电解至足够长时间.有以下结论:①溶液中几乎没有Br-;②电解液变为无色;③最终溶液呈碱性;④K+,Na+和SO42-的浓度几乎没有变化.正确的是( )
| A、①②③ | B、仅③ |
| C、①④ | D、均正确 |
二氟甲烷(CH2F2)是性能优异的环保产品,试判断二氟甲烷的结构( )
| A、有4种 | B、有3种 |
| C、有2种 | D、有1种 |
质量相同的Na、Mg、Al、Zn分别放入足量的稀盐酸中,在相同的条件下,产生氢气最多的是( )
| A、Na | B、Mg | C、Al | D、Zn |
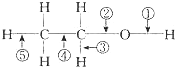 在乙醇的化学性质中,各反应的断键方式可概括如下:
在乙醇的化学性质中,各反应的断键方式可概括如下: