题目内容
1.CuCl2、CuCl广泛用于有机合成的催化剂.CuCl2容易潮解; CuCl白色粉末,微溶于水,溶于浓盐酸和氨水生成络合物,不溶于乙醇.已知:i.CuCl2+Cu+2HCl(浓)?2H[CuCl2](无色)$\stackrel{稀释}{?}$2CuCl↓(白色)+2HCl
ii.副反应:CuCl+H2O?CuOH+2HCl; CuCl+Cl-═[CuCl2]-
(1)制取CuCl2装置如图:
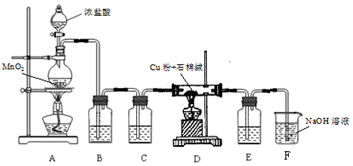
①A装置中发生反应的离子方程式是MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O.
②C、E 装置中盛放的是浓硫酸,作用是浓硫酸有吸水性,C、E防止CuCl2潮解.
③B中选择饱和食盐水而不用蒸馏水的原因是由于Cl2+H2O?H++Cl-+HClO;氯化钠电离出的Cl-,增大Cl-浓度,平衡左移,抑制了Cl2和H2O的反应,减少了Cl2消耗.
(2)制取CuCl流程如图:
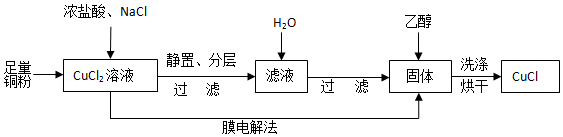
①反应①中加入NaCl的目的是增大Cl-浓度,有利于生成HCuCl2;但是Cl-浓度过高,CuCl产率降低,原因是当Cl-浓度过高时,CuCl+Cl-?[CuCl2]2-,会使CuCl溶解而降低产率.
②CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的方程式为4CuCl+4H2O+O2═2Cu2(OH)3Cl+2HCl.
③利用膜电解法制取CuCl,阴极电极反应式为Cu2++Cl-+e-═CuCl(Cu2++e-═Cu+).
④用乙醇洗涤沉淀Y的原因为洗去CuCl沉淀表面的杂质,减少溶解损耗;乙醇的沸点低,有利于干燥.
分析 (1)制取CuCl2:A装置制备氯气,制得的氯气中混有氯化氢和水蒸气,饱和食盐水能抑制反应Cl2+H2O?H++Cl-+HClO,减少氯气的消耗,故用B装置中的饱和食盐水吸收氯化氢气体,C装置用浓硫酸吸收水蒸气,干燥纯净的氯气在D中与铜生成氯化铜,最后用氢氧化钠吸收未反应完的氯气,CuCl2容易潮解,故在D、F间加E装置用浓硫酸装置中的吸收水蒸气,据此分析;
(2)将足量的铜粉与浓盐酸、氯化钠加入氯化铜溶液中反应:CuCl2+Cu+2HCl(浓)?2H[CuCl2](无色),静置分层,过滤过量的铜粉,向滤液加水稀释,2H[CuCl2](无色)$\stackrel{稀释}{?}$2CuCl↓(白色)+2HCl,过滤,用乙醇洗涤沉淀,烘干得产品,据此分析.
解答 解:(1)①A装置中为二氧化锰与浓盐酸制备氯气的反应,离子方程式为:MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O;
故答案为:MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O;
②CuCl2容易潮解,故制备氯化铁的装置需保持无水环境,故C、E 装置中盛放的是浓硫酸;
故答案为:浓硫酸有吸水性,C、E防止CuCl2潮解;
③制得的氯气中混有氯化氢,由于Cl2+H2O?H++Cl-+HClO;氯化钠电离出的Cl-,增大Cl-浓度,平衡左移,抑制了Cl2和H2O的反应,减少了Cl2消耗,故B装置中用饱和食盐水而不用蒸馏水;
故答案为:由于Cl2+H2O?H++Cl-+HClO;氯化钠电离出的Cl-,增大Cl-浓度,平衡左移,抑制了Cl2和H2O的反应,减少了Cl2消耗;
(2)①反应中加入NaCl的目的是增大Cl-浓度,促进CuCl2+Cu+2HCl(浓)?2H[CuCl2]正方向移动,有利于生成HCuCl2;当Cl-浓度过高时,CuCl+Cl-?[CuCl2]2-,会使CuCl溶解而降低产率;
故答案为:增大Cl-浓度,有利于生成HCuCl2;当Cl-浓度过高时,CuCl+Cl-?[CuCl2]2-,会使CuCl溶解而降低产率;
②CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的方程式为:4CuCl+4H2O+O2═2Cu2(OH)3Cl+2HCl;
故答案为:4CuCl+4H2O+O2═2Cu2(OH)3Cl+2HCl;
③利用膜电解法制取CuCl,阴极得电子发生还原反应,则为铜离子得电子化合价升高生成CuCl,故电极反应式为:Cu2++Cl-+e-═CuCl(Cu2++e-═Cu+);
故答案为:Cu2++Cl-+e-═CuCl(Cu2++e-═Cu+);
④由题可知,CuCl微溶于水,不溶于乙醇,用乙醇洗涤沉淀可洗去CuCl沉淀表面的杂质,减少溶解损耗;乙醇的沸点低,有利于干燥;
故答案为:洗去CuCl沉淀表面的杂质,减少溶解损耗;乙醇的沸点低,有利于干燥.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、电解原理等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | ①=②=③ | B. | ①>②>③ | C. | ①=②>③ | D. | ①=②<③ |
| A. | 混合物:草木灰、漂白粉、水玻璃、水银 | |
| B. | 化合物:纯碱、烧碱、小苏打、食醋 | |
| C. | 电解质:明矾、石膏、冰醋酸、硫酸钡 | |
| D. | 同素异形体:金刚石、石墨、C60、CO |
| A. | 立方烷( 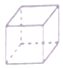 )的六氨基(-NH2)取代物有3种 )的六氨基(-NH2)取代物有3种 | |
| B. | C3H7ClO(有羟基)的同分异构体数目有5种 | |
| C. | 甲苯与氢气充分加成后的一溴代物有4种 | |
| D. | 分子式为C5H10O2的有机物中能与NaOH溶液反应的有13种 |
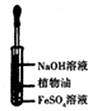
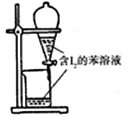
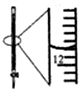
| A.配制0.10mol/LNaOH溶液 | B.观察Fe(OH)2的生成 | C.萃取碘水中的I2分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1,2-二甲苯也称邻二甲苯 | |
| B. | 氨基乙酸与a-氨基丙酸的混合物一定条件下脱水能生成4种二肽 | |
| C. | 苯与溴水不能发生加成反应,所以两者混合后无明显现象 | |
| D. | C5H10O2属于羧酸的同分异构体有4种 |
| 选项 | X | Y | Z |
| A | Cu | HNO3 | Fe(NO3)3 |
| B | FeCl3 | Zn | NaHCO3 |
| C | O2 | NH3 | SO2 |
| D | NH4Al(SO4)2 | Ba(NO3)2 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
| A. |  | B. |  | ||
| C. |  | D. |  |
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断 裂时需要吸收的能量/kJ | 436 | 230 | 369 |
| A. | 404 | B. | 72 | C. | 230 | D. | 200 |