题目内容
13.丙烯在一定条件下发生加聚反应的产物是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 丙烯含碳碳双键,可发生加聚反应,甲基在高分子的侧链上,以此来解答.
解答 解:丙烯含碳碳双键,可发生加聚反应,甲基在高分子的侧链上,生成高分子为 ,链节为
,链节为 ,
,
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意高分子化合物结构的判断,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
18.已知反应:
①101kPa时,2C(s)+O2(g)═2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=-57.3kJ/mol
下列结论正确的是( )
①101kPa时,2C(s)+O2(g)═2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=-57.3kJ/mol
下列结论正确的是( )
| A. | ①表示2molC(s)燃烧生成2molCO(g)需要吸收221 kJ的热量 | |
| B. | 碳的燃烧热大于110.5 kJ/mol | |
| C. | 稀硫酸与浓NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
5.如图是198K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
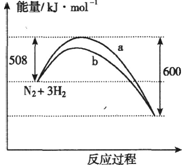

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-1 | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为69kJ,则N2的转化率为75% |
2.某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有大小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是温度计、环形玻璃搅拌棒.
(2)①实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是铜是热的良导体,有热量散失.
②在大、小烧杯之间填满碎泡沫塑料的作用是保温,减少热量散失.
(3)他们记录的实验数据如表:
已知:反应后溶液的比热容c为4.18kJ•℃-1•kg-1,各物质的密度均为1g•cm-3.计算完成上表(保留两位小数).
(4)实验分析
①若用醋酸代替HCl做实验,测得的中和热的数值偏小(填“偏大”或“偏小”或“无影响”).
②若用60mL 0.5mol•L-1HCl溶液与50mL 0.55mol•L-1NaOH溶液完成实验,与上述实验相比,测得反应放出的热量偏大(填“偏大”或“偏小”或“不变”),中和热不变(填“偏大”或“偏小”或“不变”)
(1)实验桌上备有大小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是温度计、环形玻璃搅拌棒.
(2)①实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是铜是热的良导体,有热量散失.
②在大、小烧杯之间填满碎泡沫塑料的作用是保温,减少热量散失.
(3)他们记录的实验数据如表:
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50 mL 0.55 mol•L-1 NaOH溶液 | 50 mL 0.5 mol•L-1 HCl溶液 | 20℃ | 23.3℃ | -56.8kJ/mol |
| ② | 50 mL 0.55 mol•L-1 NaOH溶液 | 50 mL 0.5 mol•L-1 HCl溶液 | 20℃ | 23.5℃ | |
(4)实验分析
①若用醋酸代替HCl做实验,测得的中和热的数值偏小(填“偏大”或“偏小”或“无影响”).
②若用60mL 0.5mol•L-1HCl溶液与50mL 0.55mol•L-1NaOH溶液完成实验,与上述实验相比,测得反应放出的热量偏大(填“偏大”或“偏小”或“不变”),中和热不变(填“偏大”或“偏小”或“不变”)
3.下列关于胶体和溶液的说法中,正确的是( )
| A. | 分散系的分类: 分散系微粒直径 分散系微粒直径 | |
| B. | 溶液是电中性的,而胶体是带电的 | |
| C. | 光线通过时,溶液产生丁达尔效应,胶体则无丁达尔效应 | |
| D. | 溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸 |