题目内容
9.已知一定温度下,2X(g)+Y(g)?mZ(g)△H=-a kJ/mol(a>0),现有甲、乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2mol X和1mol Y,达到平衡状态时,放出热量b kJ,向密闭容器乙中通入1mol X和0.5mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是( )| A. | m=4 | B. | a=b | C. | a<$\frac{b}{2}$ | D. | m<3 |
分析 甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,压强与物质的量成正比,X、Y的物质的量为2倍的关系,若平衡不移动,b=2c,现b>2c,则加压平衡正向移动,以此来解答.
解答 解:甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,压强与物质的量成正比,X、Y的物质的量为2倍的关系,若平衡不移动,b=2c,现b>2c,则加压平衡正向移动,
所以2+1>m,则m≤2,m等于2或1,
又热化学反应中2molX与1molY完全反应放出akJ热量,向密闭容器甲中通入2mol X和1mol Y,不能完全转化,放出的热量bkJ<akJ,因转化率不知,则无法确定a、b的关系,
故选D.
点评 本题考查化学平衡的计算及热化学反应中物质的量与热量的关系,明确b>2c时平衡移动的方向是解答本题的关键,题目难度中等.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
19.下列有关金属的说法中,正确的是( )
①铝合金门窗耐腐蚀 ②钠着火用水扑灭 ③KSCN溶液可以检验Fe3+④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金.
①铝合金门窗耐腐蚀 ②钠着火用水扑灭 ③KSCN溶液可以检验Fe3+④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金.
| A. | ①③④ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②⑤ |
20.将Na2O2投入FeCl3溶液中,可观察到的实验现象是( )
| A. | 有白色沉淀生成 | |
| B. | 有红棕色沉淀生成 | |
| C. | 没有沉淀生成 | |
| D. | 既有红褐色沉淀生成又有无色气体产生 |
4.近年来,多地公共汽车大部分采用天然气或燃料电池作为动力,其主要目的是( )
| A. | 减少对大气的污染 | B. | 降低成本 | ||
| C. | 防止石油短缺 | D. | 加大发动机的动力 |
14.下列说法正确的是( )
| A. | 浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂 | |
| B. | 在任何条件下都不能发生Cu+H2SO4═CuSO4+H2↑反应 | |
| C. | 浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 | |
| D. | 二氧化氮与水反应的离子方程式是3NO2+H2O═2HNO3+NO |
18.A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成.B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为AC.
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
(2)下表为B与F实验的部分内容
写出B与稀H2SO4反应的离子方程式S2O32-+2H+=S↓+SO2↑+H2O,写出②中离子反应方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
(3)现由6种粒子Mn2+、MnO4-、H+、H2O、X2Y82-(C中含有的阴离子),XY42-完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4-需氧化剂的物质的量为2.5mol.
(4)化合物D和E相互转化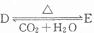 ,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为AC.
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
(2)下表为B与F实验的部分内容
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
(3)现由6种粒子Mn2+、MnO4-、H+、H2O、X2Y82-(C中含有的阴离子),XY42-完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4-需氧化剂的物质的量为2.5mol.
(4)化合物D和E相互转化
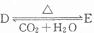 ,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O. 
 .
. .
.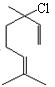 ;
;
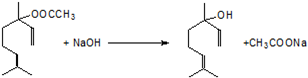 ,.
,.