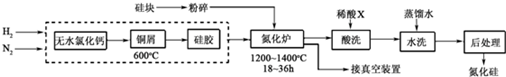
题目内容
16.在一定温度下,向不同电解质溶液中加入新物质时,其电流强度(I)随新物质加入量(m)的变化曲线不正确的是( )
| A | B | C | D |
 |  |  | [ 来源:] 来源:] |
| 向Ba(OH)2溶液中逐滴加入等浓度的H2SO4至过量 | 向醋酸溶液中逐滴加入等浓度的氨水至过量 | 向盐酸溶液中逐滴加入等浓度的NaOH溶液至过量 | 向氨水中逐滴加入等浓度的盐酸至过量 |
| A. | A | B. | B | C. | C | D. | D |
分析 液的导电性与离子浓度大小有关,离子浓度越大,溶液导电性越强,结合反应的离子方程式或化学方程式以及电解质的强弱进行判断.
解答 解:A.Ba(OH)2+H2SO4=BaSO4↓+2H2O,滴入H2SO4时生成沉淀和弱电解质,导电性减弱,完全反应后,H2SO4过量,导电性又增强,与图象一致,故A不选;
B.CH3COOH+NH3•H2O=CH3COONH4+H2O,导电性增强,但氨水过量后,将溶液稀释,导电性减弱,与图象一致,故B不选;
C.向盐酸溶液中逐滴加入等浓度的NaOH溶液会发生反应得到氯化钠溶液,溶液导电性不变,至过量相当于将溶液稀释,所以溶液导电性减弱,和图象不符,故C选;
D.向氨水中逐滴加入等浓度的盐酸会发生反应得到氯化氨溶液,导电性增强,但是盐酸过量,浓度是一样的,所以溶液导电性几乎不变,和图象相符,故D不选;
故选C
点评 本题考查电解质溶液导电性判断,为高频考点,电解质溶液导电性强弱与离子浓度成正比,与电解质强弱无关,明确反应实质及混合溶液中溶质及其性质是解本题关键,为易错题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(括号内),溶液一定不能与原来溶液一样的是( )
| A. | CuCl2(CuCl2) | B. | AgNO3(Ag2O) | C. | NaCl(NaCl) | D. | CuSO4[Cu(OH)2] |
11.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应 CO32-+2H+═CO2↑+H2O | |
| B. | 往CuCl2溶液中加入钠 2Na+Cu2+═2Na++Cu | |
| C. | 铁与稀硫酸反应 Fe+2H+═Fe2++H2↑ | |
| D. | 稀硫酸与氢氧化钡溶液反应 H++SO42-+Ba2++OH-═H2O+BaSO4↓ |
1.在碱性溶液中,能大量共存的离子是( )
| A. | Mg2+、Fe3+、NO3-、K+ | B. | Al3+、Na+、Cl-、SO42- | ||
| C. | Na+、Ba2+、NO3-、Cl- | D. | K+、Na+、Cl-、HCO3- |
8.下列实验操作正确的是( )
| A. |  酸式滴定管排气泡 | B. |  配制100 mL 0.01mol/L盐酸 | ||
| C. |  测定中和热 | D. |  验证铁与水蒸气反应生成气体 |
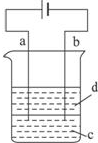 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.