题目内容
2. 制取氨气并完成喷泉实验
制取氨气并完成喷泉实验(1)写出实验室制取氨气的化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)收集氨气应使用向下排空气法,要制取干燥的氨气可选用碱石灰做干燥剂.
(3)如图进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是打开止水夹,挤压胶头滴管将水压入烧瓶,该实验的原理是氨气极易溶于水,烧瓶内的氨气溶于少量水,使烧瓶内压强迅速减小,大气压将烧杯中的水压入烧瓶
(4)反应后,烧瓶内的溶液中含有的微粒为NH3、H2O、NH3•H2O、NH4+、OH-、(H+).
分析 (1)实验室用加热氯化铵、氢氧化钙的方法制取氨气;
(2)依据氨气密度小于空气密度,极易溶于水的物理性质选择收集方法;氨气为碱性气体,应选择碱性干燥剂;
(3)利用氨气极易溶于水,形成压强差而形成喷泉;
(4)氨水中含有电解质一水合氨和水,二者都是弱电解质,依据电离平衡过程分析溶液中含有微粒.
解答 解:(1)氯化铵、氢氧化钙加热生成氨气、氯化钙和水,化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气密度小于空气密度,极易溶于水,所以应选择向下排空气法;氨气为碱性气体,应选择碱性干燥,碱石灰为碱性干燥剂,可以干燥氨气;
故答案为:向下排空气法; 碱石灰;
(3)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,大气压将烧杯中的水压入烧瓶,而形成喷泉;
故答案为:打开止水夹,挤出胶头滴管中的水;氨气极易溶于水,烧瓶内的氨气溶于少量水,使烧瓶内压强迅速减小,大气压将烧杯中的水压入烧瓶;
(4)氨水中存在化学平衡:NH3+H2O?NH3•H2O?NH4++OH-;H2O?H++OH-溶液中存在三种分子:NH3、H2O、NH3•H2O;三种离子:NH4+、OH-、H+;
故答案为:NH3、H2O、NH3•H2O; NH4+、OH-、H.
点评 本题考查了氨气的制备和收集及性质的检验,明确制备原理和喷泉实验的原理是解题关键,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
10.将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
| A. | 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 | |
| B. | 2.0 mol SO2+1.0 mol O2+2.0 mol SO3 | |
| C. | 3.0 mol SO2+0.5 mol O2+1.0 mol SO3 | |
| D. | 3.0 mol SO2+1.0 mol O2+1.0 mol SO3 |
17.关于制备Fe(OH)3胶体的操作方法正确的是( )
| A. | 在FeCl3溶液中加入NaOH溶液 | B. | 加热煮沸FeCl3溶液 | ||
| C. | 把FeCl3溶液滴入沸水中 | D. | 把饱和的FeCl3溶液滴入到沸水中 |
7.2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)在该可逆反应中,当化学平衡逆向移动时,体系气体的平均分子量会( )
| A. | 不确定 | B. | 变小 | C. | 不变 | D. | 变大 |
11.下列关于物质应用的说法中错误的是( )
| A. | 光导纤维中所用材料为晶体硅 | B. | 水玻璃可用作木材防火剂 | ||
| C. | 氯气可用于自来水的杀菌消毒 | D. | Fe2O3可以做油漆的颜料 |
12.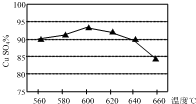 将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示.生产过程中应将温度控制在600℃左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是CuSO4发生了分解反应.
(2)如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).实验中可选用的试剂和用品:稀硫酸、3% H2O2溶液、CuO、玻璃棒、精密pH试纸.
①实验时需用约3%的H2O2溶液100mL,现用市售30%(密度近似为1g•cm-3)的H2O2来配制,其具体配制方法是用量筒量取10mL30%H2O2溶液加入烧杯中,再加入90mL 水(或加水稀释至 100mL),搅拌均匀.
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤.
第二步:向滤液中加入稍过量3% H2O2溶液,充分反应.
第三步:向溶液中加入CuO,用精密pH试纸控制pH在3.2~4.7之间,过滤.
第四步:加热浓缩、冷却结晶.
第五步:过滤、洗涤,低温干燥.
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O.
 将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示.生产过程中应将温度控制在600℃左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是CuSO4发生了分解反应.
(2)如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).实验中可选用的试剂和用品:稀硫酸、3% H2O2溶液、CuO、玻璃棒、精密pH试纸.
| 粒子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤.
第二步:向滤液中加入稍过量3% H2O2溶液,充分反应.
第三步:向溶液中加入CuO,用精密pH试纸控制pH在3.2~4.7之间,过滤.
第四步:加热浓缩、冷却结晶.
第五步:过滤、洗涤,低温干燥.
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O.