题目内容
16.下列离子中,电子数大于质子数且质子数大于中子数的是( )| A. | NH4+ | B. | Li+ | C. | OD- | D. | OH- |
分析 电子数大于质子数,则微粒带负电,质子数大于中子数,只能是计算微粒的原子中质子数与中子数的多少,其中明确氢元素的不同原子中中子个数的情况是解决此题的必要条件.
解答 解:A.NH4+微粒带正电,电子数小于质子数,故A错误;
B.Li+微粒带正电,电子数小于质子数,故B错误;
C.OD-微粒带负电,电子数大于质子数,质子数为8+1=9,中子数为8+1=9,故C错误;
D.OH-微粒带负电,电子数大于质子数,质子数为8+1=9,中子数为8+0=8,质子数大于中子数,故D正确;
故选D.
点评 本题是对微粒结构的考查,解题的关键是对相关原子的结构的把握,属基础性知识考查题,题目难度不大.

练习册系列答案
相关题目
6.在铜锌原电池中,下列叙述正确的是( )
| A. | 正极附近硫酸根离子浓度增大 | |
| B. | 负极附近硫酸根离子浓度增大 | |
| C. | 正负极附近硫酸根离子浓度基本不变 | |
| D. | 若锌片、铜片同时有气泡冒出时,说明锌做正极 |
7.下列元素的原子半径最大的是( )
| A. | 氯 | B. | 硫 | C. | 氧 | D. | 氢 |
4.下列表示正确的是( )
| A. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- | |
| B. | CO(g)的燃烧热是283.0kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=-566.0kJ•mol-1 | |
| C. | 含有大量AlO2-的溶液中:K+、CO32-、Br-、NH4+可共存 | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有CO32- |
1.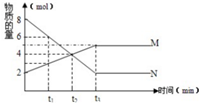 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | t3时,正反应速率大于逆反应速率 | |
| B. | t2时,正逆反应速率相等,反应达到平衡状态 | |
| C. | 化学方程式为:2M=N | |
| D. | t1时,N的浓度是M浓度的2倍 |
8.室温时下列各组离子能大量共存的是( )
| A. | 在含大量Fe3+的溶液中:Na+、Cl-、SCN- | |
| B. | 在含大量Al3+的溶液中:Na+、HCO3-、Cl- | |
| C. | $\frac{\\;c(H+)}{c(OH-)}$=10-12溶液中:K+、AlO2-、CO32- | |
| D. | pH=0的溶液中:K+、I-、NO3- |
5.相同物质的量浓度的NaX、NaY、NaZ三种盐溶液的pH分别为7、8、9,则相同物质的量浓度的HX、HY、HZ的酸性强弱顺序为( )
| A. | HX、HY、HZ | B. | HZ、HY、HX | C. | HX、HZ、HY | D. | HZ、HY、HX |
13.(1)已知
25℃,101kPa时:4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1 648kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393kJ•mol-1
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1 480kJ•mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇.发生的主要反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
由此计算△H1=-99kJ•mol-1;已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1.
25℃,101kPa时:4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1 648kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393kJ•mol-1
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1 480kJ•mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇.发生的主要反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |