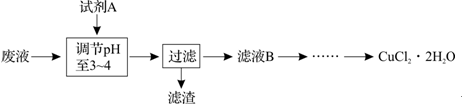
题目内容
 (1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化关系:
R3+
| OH- |
| H+ |
| OH- |
| H+ |
①基态R原子的价电子排布式为
②该R元素的一种含氧酸根离子R2O72-在酸性条件下具有很强的氧化性,其还原产物为R3+,试写出该含氧酸离子与氯化亚铁溶液反应的离子反应程式
考点:元素电离能、电负性的含义及应用,原子核外电子排布,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)根据元素非金属性的递变规律分析;
(2)由电离能大小可判断原子最外层电子数,进而可推断化合价;价电子排布处于全充满、半充满状态时,较稳定;
(3)由H2O2的结构可知,O原子形成1个O-H键、1个O-O键,含有2对孤对电子,杂化轨道数为4,据此判断杂化方式;H2O2中氧元素的电负性很强,H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶;
(4)R是1~36号元素中未成对电子数最多的原子,则R原子外围电子排布为3d54s1,为Cr元素;
Cr2O72-在酸性条件下具有很强的氧化性,其还原产物为Cr3+,能将Fe2+氧化为Fe3+.
(2)由电离能大小可判断原子最外层电子数,进而可推断化合价;价电子排布处于全充满、半充满状态时,较稳定;
(3)由H2O2的结构可知,O原子形成1个O-H键、1个O-O键,含有2对孤对电子,杂化轨道数为4,据此判断杂化方式;H2O2中氧元素的电负性很强,H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶;
(4)R是1~36号元素中未成对电子数最多的原子,则R原子外围电子排布为3d54s1,为Cr元素;
Cr2O72-在酸性条件下具有很强的氧化性,其还原产物为Cr3+,能将Fe2+氧化为Fe3+.
解答:
解:(1)与Cl相邻元素有F和S,F和Cl在同一主族,非金属性:F>Cl,Cl和S在同一周期,非金属性:Cl>S,则非金属性:F>Cl>S,故答案为:F>Cl>S;
(2)由电离能数据可知,R易失去3个电子,则原子最外层电子数为3,最高化合价为+3价,
A、B、C为同一短周期金属元素,由电离能数据可知,A为Na元素,B为Mg元素,R为Al元素,
Na+外层电子排布为2s22p6稳定结构,难再失去一个电子,Mg+外层电子排布为3s1,易失去一个电子,所以第二电离能(I2)Mg小于Na,
故答案为:+3;A+外层电子排布为2s22p6稳定结构,难再失去一个电子,B+外层电子排布为3s1,易失去一个电子;
(3)由H2O2的结构可知,O原子形成1个O-H键、1个O-O键,含有2对孤对电子,杂化轨道数为4,杂化方式为sp3,H2O2中氧元素的电负性很强,H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶,
故答案为:sp3;H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶;
(4)①R是1~36号元素中未成对电子数最多的原子,则R原子外围电子排布为3d54s1,故答案为:3d54s1;
②Cr2O72-在酸性条件下具有很强的氧化性,其还原产物为Cr3+,能将Fe2+氧化为Fe3+,结合电子转移守恒可知,Cr2O72-与氯化亚铁溶液反应的离子反应程式为:Cr2O72-+6Fe2++14H+=2Cr3++7H2O+6Fe3+故答案为:Cr2O72-+6Fe2++14H+=2Cr3++7H2O+6Fe3+.
(2)由电离能数据可知,R易失去3个电子,则原子最外层电子数为3,最高化合价为+3价,
A、B、C为同一短周期金属元素,由电离能数据可知,A为Na元素,B为Mg元素,R为Al元素,
Na+外层电子排布为2s22p6稳定结构,难再失去一个电子,Mg+外层电子排布为3s1,易失去一个电子,所以第二电离能(I2)Mg小于Na,
故答案为:+3;A+外层电子排布为2s22p6稳定结构,难再失去一个电子,B+外层电子排布为3s1,易失去一个电子;
(3)由H2O2的结构可知,O原子形成1个O-H键、1个O-O键,含有2对孤对电子,杂化轨道数为4,杂化方式为sp3,H2O2中氧元素的电负性很强,H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶,
故答案为:sp3;H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶;
(4)①R是1~36号元素中未成对电子数最多的原子,则R原子外围电子排布为3d54s1,故答案为:3d54s1;
②Cr2O72-在酸性条件下具有很强的氧化性,其还原产物为Cr3+,能将Fe2+氧化为Fe3+,结合电子转移守恒可知,Cr2O72-与氯化亚铁溶液反应的离子反应程式为:Cr2O72-+6Fe2++14H+=2Cr3++7H2O+6Fe3+故答案为:Cr2O72-+6Fe2++14H+=2Cr3++7H2O+6Fe3+.
点评:本题考查电负性、电离能、化学键与杂化轨道、氢键对物质性质影响、核外电子排布规律等,难度中等,注意理解第一电离能与化合价关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用锌片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
| A、加热 |
| B、加入少量K2SO4溶液 |
| C、用粗锌(含铜、银)而不用纯锌 |
| D、滴加少量CuSO4溶液 |
在一定温度下,一固定容积的密闭容器中,反应 2NO2(g)?N2O4(g)达到平衡的标志是( )
| A、化学反应速率 |
| B、混合气体的密度保持不变 |
| C、混合气体的颜色保持不变 |
| D、混合气体的体积保持不变 |
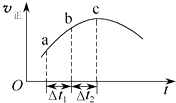 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A、反应物的总能量低于生成物的总能量 |
| B、反应物浓度:a点小于b点 |
| C、△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
| D、反应在c点达到平衡状态 |
以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+
O2(g)═2CO2(g)+H2O(l);△H=-1300kJ?mol-1的说法中,正确的是( )
| 5 |
| 2 |
| A、10个电子转移时,该反应放出1300kJ的能量 |
| B、NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C、有2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D、有8NA个碳氧共用电子对生成时,放出1300kJ的能量 |
下列各组溶液,不用其他试剂就不能鉴别的是( )
| A、FeC13、NaNO3、Na2CO3、NaC1 |
| B、NaOH、MgSO4、Na2CO3、NaHSO4 |
| C、AgNO3、KNO3、KC1、NaBr |
| D、HC1、BaC12、NaOH、CuSO4 |