题目内容
在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中, 是氧化产物;电子转移的总数为 ,氧化剂与还原剂的物质的量之比为: .
考点:氧化还原反应
专题:氧化还原反应专题
分析:化合价升高的元素被氧化,化合价降低的元素所在的反应物是氧化剂,对应的产物是还原产物,化合价升高的元素所在的反应物是还原剂,化合价升高数目=化合价降低数目=转移的电子数目,根据反应中发生化合价变化的量来判断氧化剂与还原剂的物质的量之比.
解答:
解:在K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O反应中,氯元素化合价升高,所以氯元素被氧化,HCl是还原剂,其产物Cl2为氧化产物,铬元素化合价降低,所以K2Cr2O7是氧化剂,对应的产物CrCl3是还原产物,化合价升高数目=化合价降低数目=转移的电子数目=6,反应中当1molK2Cr2O7得电子时,有6molHCl被氧化,则氧化剂与还原剂的物质的量之比为为1:6;
故答案为:Cl;6;1:6.
故答案为:Cl;6;1:6.
点评:本题考查氧化还原反应,同时考查学生对基础知识掌握情况,熟练掌握基本概念、常见元素化合价,题目难度不大.

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
一定温度时,反应2HI(g)?H2(g)+I2(g);△H>0 达到平衡,要使混合气体颜色加深,可采用的方法是( )
| A、减小压强 |
| B、缩小体积 |
| C、降低温度 |
| D、增大H2的浓度 |
电量计是由电解质溶液和置于其中的两个电极所构成.使用时,将其串联到电路中,通电一段时间后,精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,用法拉第定律求出所通过的电量.已知电极上每通过96500C的电量就会有1mol电子发生转移. 实际测量中,常用银电量计,如图所示.下列说法正确的是( )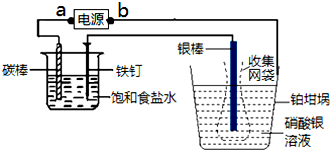

| A、a为电源的负极,铂坩埚为阳极 |
| B、称量电解前后铂坩埚的质量变化,得金属银的沉积量为108.0 mg,则电解过程中通过电解池的电量为96500C |
| C、实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋.若没有收集网袋,测量结果会偏高 |
| D、铁钉和碳棒上都有气泡产生,若加入酚酞试剂,先在碳棒附近溶液变红色 |
下列反应既是氧化还原反应,而且△H>0的是( )
| A、铝片与稀H2SO4反应 |
| B、Ba(OH)2?8H2O与NH4Cl的反应 |
| C、灼热的炭与CO2反应 |
| D、甲烷在O2中的燃烧反应 |
仅改变下列一个条件,通过提高活化分子的百分数来提高反应速率的是( )
| A、加热 | B、加压 |
| C、降温 | D、加大反应物浓度 |
下列反应中,既属于氧化还原反应又属于置换反应的是( )
A、CuO+CO
| ||||
| B、2KClO3+I2═2KIO3+Cl2 | ||||
| C、O3+Na2SO3═Na2SO4+O2 | ||||
| D、2FeCl3+2HI═I2+2FeCl2+2HCl |
下列食品中属于碱性食品的是( )
| A、鸡肉 | B、牛肉 | C、柠檬 | D、鱼肉 |
 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.