题目内容
【题目】如图两种化合物的结构或性质描述正确的是
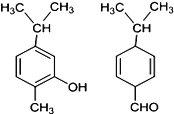
A. 两种化合物均是芳香烃
B. 两种化合物可用红外光谱区分,但不能用核磁共振氢谱区分
C. 两种化合物分子中共平面的碳原子数相同
D. 两种化合物互为同分异构体,均能与溴水反应
【答案】D
【解析】
A.第一种物质含有苯环,属于芳香烃,第二种物质含有碳碳双键,不属于芳香烃,故A错误;
B.两种有机物H原子位置不同,可用核磁共振氢谱区分,故B错误;
C.第一种物质含有苯环,8个C原子共面,第二种物质含有碳碳双键,7个C原子共面,故C错误;
D.二者分子式相同而结构不同,所以二者是同分异构体,第一种物质含有酚羟基,可与溴水发生取代反应,第二种物质含有碳碳双键,可与溴水发生加成反应,故D正确。
故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目