题目内容
(1)请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2只含有极性键的是 ,既有离子键又有非极性键的是 ;既有离子键又有极性键的是 .
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为: ;若XY2为共价化合物时,其结构式为: .
(3)现有a~g 7种短周期元素,它们在周期表中的位置如图,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是 (填序号,下同),容易形成共价键的是 ;
A.c和f B.b和g C.d和g D.b和e
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式 .
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2只含有极性键的是
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:
(3)现有a~g 7种短周期元素,它们在周期表中的位置如图,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是
A.c和f B.b和g C.d和g D.b和e
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式
考点:元素周期律和元素周期表的综合应用,化学键
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
(2)X、Y两种主族元素能形成XY2型化合物,XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X为第IIA族元素、Y为第VIIA族元素,其电子数是38,则为CaF2;若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2;
(3)根据元素在周期表中的位置知,a、b、c、d、e、f、g分别是H、Na、Mg、C、N、P、Cl元素,
①一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
②在ABn型化合物中,如果A的族序数+成键电子对数=8,则该分子中所有原子都达到8电子稳定结构.
(2)X、Y两种主族元素能形成XY2型化合物,XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X为第IIA族元素、Y为第VIIA族元素,其电子数是38,则为CaF2;若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2;
(3)根据元素在周期表中的位置知,a、b、c、d、e、f、g分别是H、Na、Mg、C、N、P、Cl元素,
①一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
②在ABn型化合物中,如果A的族序数+成键电子对数=8,则该分子中所有原子都达到8电子稳定结构.
解答:
解:(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,
只含有极性键的是⑥⑦⑨,既有离子键又有非极性键的是④;既有离子键又有极性键的是③⑤,
故答案为:⑥⑦⑨;④;③⑤;
(2)X、Y两种主族元素能形成XY2型化合物,XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X为第IIA族元素、Y为第VIIA族元素,其电子数是38,则为CaF2,其电子式为 ,若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2,其结构式为S=C=S,故答案为:
,若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2,其结构式为S=C=S,故答案为: ;S=C=S;
;S=C=S;
(3)根据元素在周期表中的位置知,a、b、c、d、e、f、g分别是H、Na、Mg、C、N、P、Cl元素,
①一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,所以容易形成离子键的是BD,易形成共价键的是C,故答案为:BD;C;
②在ABn型化合物中,如果A的族序数+成键电子对数=8,则该分子中所有原子都达到8电子稳定结构,
如CCl4,故答案为:CCl4.
只含有极性键的是⑥⑦⑨,既有离子键又有非极性键的是④;既有离子键又有极性键的是③⑤,
故答案为:⑥⑦⑨;④;③⑤;
(2)X、Y两种主族元素能形成XY2型化合物,XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X为第IIA族元素、Y为第VIIA族元素,其电子数是38,则为CaF2,其电子式为
 ,若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2,其结构式为S=C=S,故答案为:
,若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2,其结构式为S=C=S,故答案为: ;S=C=S;
;S=C=S;(3)根据元素在周期表中的位置知,a、b、c、d、e、f、g分别是H、Na、Mg、C、N、P、Cl元素,
①一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,所以容易形成离子键的是BD,易形成共价键的是C,故答案为:BD;C;
②在ABn型化合物中,如果A的族序数+成键电子对数=8,则该分子中所有原子都达到8电子稳定结构,
如CCl4,故答案为:CCl4.
点评:本题考查了化学键、元素周期表的综合应用等知识点,根据物质的构成微粒确定化学键类型,知道8电子稳定结构的判断方法,题目难度不大.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
最近研制出一种新材料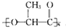 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )| A、聚乳酸是一种纯净物 |
B、聚乳酸的单体是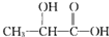 |
| C、聚乳酸是一种羧酸 |
| D、聚乳酸是由其单体通过加聚反应合成的 |
下列判断正确的是( )
| A、沸点:NH3>AsH3>PH3 |
| B、熔点:MgCl2>SiO2>CO2 |
| C、酸性:H3PO4>H2SO4>HClO4 |
| D、碱性:LiOH>NaOH>KOH |




 如图所示为NaCl晶体的晶胞示意图.
如图所示为NaCl晶体的晶胞示意图.