题目内容
9.海水中溴的储藏量丰富,有“海洋元素”之称.其工业提取方法有:(1)空气吹出纯碱吸收法.方法是将氯气通入到富含溴离子的海水中,把溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质.该方法涉及到的反应有
①Cl2+2Br-═2Cl-+Br2(写出离子方程式);
②3Br2+3CO32-═BrO3-+5Br-+3CO2↑;
③BrO3-+5Br-+6H+═3Br2+3H2O(写出离子方程式).
(2)空气吹出SO2吸收法.该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴.写出用SO2吸收溴的化学方程式:Br2+SO2+2H2O═2HBr+H2SO4.
(3)溶剂萃取法.该法是利用单质溴在水中和有机溶剂中溶解度的不同的原理来进行的.下列可以用于海水中溴的萃取的溶剂是②③(填序号).
①乙醇②四氯化碳③对二甲苯.
分析 (1)①为氯气通入到富含溴离子的海水中,把溴置换出来;③为用硫酸酸化,即可得到溴单质;
(2)用SO2吸收溴,发生氧化还原反应生成硫酸和HBr;
(3)用于海水中溴的萃取,选择与溴不反应,不溶于水的有机溶剂.
解答 解:(1)①为氯气通入到富含溴离子的海水中,把溴置换出来,离子反应为Cl2+2Br-═2Cl-+Br2;
③为用硫酸酸化,即可得到溴单质,离子反应为BrO3-+5Br-+6H+═3Br2+3H2O,
故答案为:Cl2+2Br-═2Cl-+Br2;BrO3-+5Br-+6H+═3Br2+3H2O;
(2)用SO2吸收溴,发生氧化还原反应生成硫酸和HBr,化学反应为Br2+SO2+2H2O═2HBr+H2SO4,
故答案为:Br2+SO2+2H2O═2HBr+H2SO4;
(3)用于海水中溴的萃取,选择与溴不反应,不溶于水的有机溶剂,而乙醇与水互溶,四氯化碳、对二甲苯均可作萃取剂,故答案为:②③.
点评 本题考查海水资源的综合应用,为高频考点,把握混合物分离方法、物质的性质及发生的反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
19.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
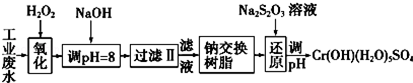
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
4.对于苯乙烯(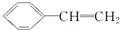 )有下列叙述:
)有下列叙述:
①能使酸性KMnO4溶液褪色;
②能使溴的四氯化碳溶液褪色;
③可溶于水;
④可溶于苯中;
⑤能与浓硝酸发生取代反应;
⑥所有的原子一定共平面.
其中正确的是( )
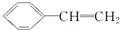 )有下列叙述:
)有下列叙述:①能使酸性KMnO4溶液褪色;
②能使溴的四氯化碳溶液褪色;
③可溶于水;
④可溶于苯中;
⑤能与浓硝酸发生取代反应;
⑥所有的原子一定共平面.
其中正确的是( )
| A. | ①②③④⑤ | B. | ①②⑤⑥ | C. | ①②④⑤⑥ | D. | ①②④⑤ |
14.下列操作和所得结论均正确的是( )
| 选项 | 实 验 操 作 | 结 论 |
| A | 用容量瓶配制溶液时,若定容摇匀后液面低于刻度线,补加水至与刻度线相平 | 所配溶液浓度不受影响 |
| B | 用湿润的pH试纸测定氯水的pH | 所测溶液的pH偏大 |
| C | 取少量试液于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 若红色石蕊试纸变蓝 则所取溶液含NH4+ |
| D | 用托盘天平称取一定质量的NaCl固体,左盘放砝码,右盘放固体 | 所称NaCl质量一定偏小 |
| A. | A | B. | B | C. | C | D. | D |
1.下列各组物质的性质,从左到右依次递减的是( )
| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 酸性:HClO4、H2SO4、H3PO4 | ||
| C. | 还原性:HCl、HBr、HI | D. | 原子半径:S、Na、O |
18.已知2H→H2放出437.6kJ的热量,下列说法正确的是( )
| A. | 氢气分子内每个氢原子都达到了8电子稳定结构 | |
| B. | 1 mol H2的能量比2 mol H的能量低 | |
| C. | 1 mol H2离解成2 mol H要放出437.6 kJ热量 | |
| D. | 氢原子不如氢分子活泼 |
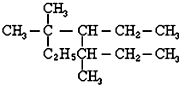 的名称是3,3,5-三甲基-4-乙基庚烷.
的名称是3,3,5-三甲基-4-乙基庚烷.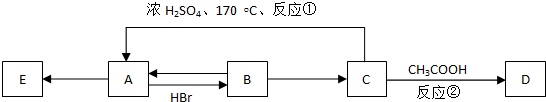
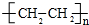 .
.