题目内容
在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)?2HI(g).
(1)反应刚开始时,由于c(H2)= ,c(I2)= ,而c(HI)= ,所以化学反应速率 最大而 最小(为零)(填“v正”或“v逆”).
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2) ,c(I2) ,而c(HI) ,从而化学反应速率v正 ,而v逆 (填“增大”、“减小”或“不变”).
(3)当反应进行到v正与v逆 时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将 .
(4)若将1molH2和1molI2(g)充入一密闭容器中,则下列状态属于平衡状态的是
A.混合气体的体积等于最初体积一半的状态
B.H2、I2、HI总物质的量不随时间延长而改变的状态
C.混合气体的颜色不随时间延长而改变的状态
D.单位时间内有0.5molHI分解的同时,有0.25molH2生成的状态
E.混合气体的密度不随时间延长而改变的状态.
(1)反应刚开始时,由于c(H2)=
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)
(3)当反应进行到v正与v逆
(4)若将1molH2和1molI2(g)充入一密闭容器中,则下列状态属于平衡状态的是
A.混合气体的体积等于最初体积一半的状态
B.H2、I2、HI总物质的量不随时间延长而改变的状态
C.混合气体的颜色不随时间延长而改变的状态
D.单位时间内有0.5molHI分解的同时,有0.25molH2生成的状态
E.混合气体的密度不随时间延长而改变的状态.
考点:化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)根据公式c=
来计算各物质的浓度,开始阶段反应正向进行达平衡状态;
(2)开始阶段反应正向进行,反应物浓度减小,生成物浓度增大,直到达平衡状态,正逆速率相等;
(3)可逆反应就达到的最大限度是达平衡状态,正逆速率相等;平衡状态时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将保持不变;
(4)平衡状态时,各组分的浓度保持不变,正逆反应速率相等,检查判断.
| n |
| V |
(2)开始阶段反应正向进行,反应物浓度减小,生成物浓度增大,直到达平衡状态,正逆速率相等;
(3)可逆反应就达到的最大限度是达平衡状态,正逆速率相等;平衡状态时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将保持不变;
(4)平衡状态时,各组分的浓度保持不变,正逆反应速率相等,检查判断.
解答:
解:(1)根据公式c=
可以计算出C(H2)=
mol/L,C(I2)=
mol/L,C(HI)=0,开始阶段反应正向进行,ν(正)最大,ν(逆)=0,
故答案为:
mol/L;
mol/L;0;ν(正); ν(逆);
(2)随着反应的进行,反应物浓度减小,生成物浓度增大,正反应速率减小,逆反应速率增大,直到达平衡状态,正逆速率相等,
故答案为:减小;减小;增大;减小;增大;
(3)可逆反应就达到的最大限度是达平衡状态,平衡状态的标志是ν(正)与ν(逆)相等,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将保持不变,故答案为:相等;保持不变;
(4)A、反应前后气体体积不变,故A错误;
B、反应前后气体的物质的量不变,故B错误;
C、气体颜色不变说明碘蒸气的浓度不变,达到平衡状态,故C正确;
D、有0.5molHI分解的同时,有0.25molH2生成,说明逆反应速度,不能说明反应达到平衡状态,故D错误;
E、容器体积不变,气体质量不变,密度永远不变,故E错误;
故选C.
| n |
| V |
| a |
| V |
| b |
| V |
故答案为:
| a |
| V |
| b |
| V |
(2)随着反应的进行,反应物浓度减小,生成物浓度增大,正反应速率减小,逆反应速率增大,直到达平衡状态,正逆速率相等,
故答案为:减小;减小;增大;减小;增大;
(3)可逆反应就达到的最大限度是达平衡状态,平衡状态的标志是ν(正)与ν(逆)相等,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将保持不变,故答案为:相等;保持不变;
(4)A、反应前后气体体积不变,故A错误;
B、反应前后气体的物质的量不变,故B错误;
C、气体颜色不变说明碘蒸气的浓度不变,达到平衡状态,故C正确;
D、有0.5molHI分解的同时,有0.25molH2生成,说明逆反应速度,不能说明反应达到平衡状态,故D错误;
E、容器体积不变,气体质量不变,密度永远不变,故E错误;
故选C.
点评:本题考查学生化学平衡状态的建立、平衡移动以及化学平衡状态的特征,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
一定温度下,mg某物质A在足量氧气中充分燃烧,使燃烧产物跟足量过氧化钠反应,过氧化钠质量增加了ng,且n=m,以下符合此要求的物质有几个( )
①CH3OH ②C6H12O6 ③CH4 ④HCOOCH3⑤CH3CHO.
①CH3OH ②C6H12O6 ③CH4 ④HCOOCH3⑤CH3CHO.
| A、1 | B、2 | C、3 | D、4 |
在一定条件下的恒温恒容容器中,当下列物理量不再发生变化时,反应:A(g)+3B(g)?2C(g)+D(g)不能表明已达平衡状态的是( )
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、B的物质的量浓度 |
| D、气体总物质的量 |
化学与生活、社会密切相关.下列说法不正确的是( )
| A、凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| B、提倡人们购物时不用塑料袋,是为了防止白色污染 |
| C、防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A、节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
| B、小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 |
| C、为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 |
| D、面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于过氧化物,过氧化苯甲酰属于有机物 |
对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),△H<0下列叙述正确的是( )
| A、化学反应速率关系是:2υ正(NH3)═3υ正(H2O) |
| B、若升高温度,逆向反应速率增加,正向反应速率减小 |
| C、达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 |
| D、达到化学平衡时,4υ正(O2)═5υ逆(NO) |
下列有机反应属于消去反应的是( )
A、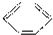 +HONO2 +HONO2
 +H2O +H2O | |||
B、CH3CH3OH+CH3COOH
| |||
C、CH3CH2OH
| |||
| D、BrCH=CHBr+Br2→CHBr2CHBr2 |
下列溶液中,溶质的物质的量浓度为1mol?L-1的是( )
| A、将40g NaOH溶于1L水所得的溶液 |
| B、将0.5mol?L-1的NaNO3溶液100mL加热蒸发掉50g水所得的溶液 |
| C、将23g Na溶于水并配成1L的溶液 |
| D、从1L 2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L |