题目内容
下列离子化合物中,阴、阳离子电子层结构相同的是( )
| A、氧化镁 | B、氯化钠 |
| C、溴化钠 | D、氯化镁 |
考点:原子结构与元素的性质
专题:原子组成与结构专题
分析:离子化合物中,阴阳离子电子层结构相同,说明阳离子元素位于阴离子元素下一周期,且阴阳离子核外电子数相等,据此分析解答.
解答:
解:A.氧化镁中氧离子和镁离子核外电子数都是10,其阴阳离子电子层结构相同,故A正确;
B.NaCl中钠离子核外有10个电子、Cl离子核外有18个电子,氯离子电子层比钠离子多一个,电子层结构不同,故B错误;
C.NaBr中钠离子核外有10个电子、溴离子核外有36个电子,溴离子比钠离子多2个电子层,电子层结构不同,故C错误;
D.氯化镁中镁离子核外有10个电子、氯离子核外有18个电子,氯离子比钠离子多一个电子对,其电子层结构不同,故D错误;
故选A.
B.NaCl中钠离子核外有10个电子、Cl离子核外有18个电子,氯离子电子层比钠离子多一个,电子层结构不同,故B错误;
C.NaBr中钠离子核外有10个电子、溴离子核外有36个电子,溴离子比钠离子多2个电子层,电子层结构不同,故C错误;
D.氯化镁中镁离子核外有10个电子、氯离子核外有18个电子,氯离子比钠离子多一个电子对,其电子层结构不同,故D错误;
故选A.
点评:本题考查了原子结构和元素性质,明确原子核外电子排布及原子结构即可解答,电子层结构相同的离子中电子数相等,题目难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
若ag某气体中含有的分子数为b,则cg该气体的物质的量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列有关晶体的大小比较不正确的是( )
| A、阴离子的配位数:CsCl>NaCl>CaF2 |
| B、热分解温度:BaCO3>CaCO3>MgCO3 |
| C、熔点:NaF>MgF2>AlF3 |
| D、硬度:C3N4>金刚石>碳化硅 |
下列说法与盐的水解无关的是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,溶液时往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤将FeCl3溶液蒸干并灼烧,得到的固体是Fe2O3;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,溶液时往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤将FeCl3溶液蒸干并灼烧,得到的固体是Fe2O3;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
| A、①③⑥ | B、②③⑤ |
| C、③④⑤ | D、全有关 |
根据物质的熔点、沸点数据,推断错误的是( )
| 晶体 | NaCl | MgO | AlCl3 | SiCl4 | B(硼) |
| 熔点℃ | 801 | 2852 | 180 | -70 | 2300 |
| 沸点℃ | 1465 | --- | 177 | 57 | 2500 |
| A、晶体的沸点CCl4<SiCl4 |
| B、在火山喷出的岩浆,晶出顺序为MgO先于NaCl |
| C、用AlCl3通过电解法冶炼铝 |
| D、硼的硬度大,不溶于水,但能与NaOH溶液反应 |
用如图实验装置进行相应实验,能达到实验目的是( )

| A、用图1所示装置分离沸点相差较大的互溶液体混合物 |
| B、用图2所示装置蒸干FeCl2饱和溶液制备FeCl2晶体 |
| C、用图3所示装置稀释浓硫酸 |
| D、用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
下列关于图的实验装置说法正确的是( )
A、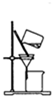 该图装置可以提纯精制氢氧化铁胶体 |
B、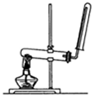 该图装置可以用来制备和收集氨气和氧气 |
C、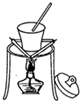 该图可以从食盐水中得到食盐晶体 |
D、 该图试管中放新制FeSO4溶液,从滴管中滴加NaOH溶液,易于观察到Fe(OH)2颜色 |
某气态烃在密闭容器内与氧气混合完全燃烧,如果燃烧前后容器内(温度高于1000C)压强保持不变,该烃可能是( )
| A、C2H6 |
| B、C2H4 |
| C、C3H8 |
| D、C3H6 |