题目内容
7.常温下,将某一元酸HA和NaOH溶液等体积混合,混合后所得溶液的pH如下表:| 实验编号 | HA的浓度(mol/L) | NaOH的浓度(mol/L) | 混合溶液的PH |
| 甲 | 0.2 | 0.2 | PH=a |
| 乙 | C1 | 0.2 | PH=7 |
| 丙 | 0.1 | 0.1 | PH=10 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来判断HA是强酸还是弱酸:若a=7,则说明HA为强酸;若a>7,则说明HA为弱酸.
(2)试表示出甲组混合液中的电荷守恒关系c(H+)+c(Na+)=c(OH-)+c(A-)
(3)单从乙组情况分析,若HA是弱酸,则C1>0.2mol/L(填“>”“<”“=”).此时混合溶液中c(A-)=c(Na+)(填“>”“<”“=”)
(4)丙组实验所得混合溶液中由水电离出的c(OH-)=10-4mol/L.
分析 (1)混合恰好反应得到NaA溶液,若溶液呈中性,则HA为强酸,若溶液呈碱性,则HA为弱酸;
(2)阳离子所带正电荷总量等于阴离子所带负电荷总量;
(3)若HA为弱酸,恰好反应得到NaA溶液呈碱性,而溶液pH=7,则HA稍过量些;根据电荷守恒判断c(A-)、c(Na+)相对大小;
(4)恰好反应得到NaA溶液,溶液呈碱性,溶液中氢氧根离子为水电离得到.
解答 解:(1)HA与NaOH的物质的量相等,混合恰好反应得到NaA溶液,若a=7,则说明HA为强酸;若a>7,则说明HA为弱酸,
故答案为:若a=7,则说明HA为强酸;若a>7,则说明HA为弱酸;
(2)根据电荷守恒可得:c(H+)+c(Na+)=c(OH-)+c(A-),
故答案为:c(H+)+c(Na+)=c(OH-)+c(A-);
(3)若HA为弱酸,恰好反应得到NaA溶液呈碱性,而溶液pH=7,则HA稍过量些,HA与NaOH按物质的量1:1反应,且溶液体积相等,则C1>0.2mol/L,此时反应中c(OH-)=c(H+),由电荷守恒c(H+)+c(Na+)=c(OH-)+c(A-),联立可得:c(Na+)=c(A-),
故答案为:>;=;
(4)HA与NaOH的物质的量相等,恰好反应得到NaA溶液,溶液中氢氧根离子为水电离得到,则由水电离出的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4mol/L,
故答案为:10-4.
点评 本题考查盐类水解、溶液pH计算、离子浓度大小比较知识,有一定的综合性,侧重于学生的分析能力和计算能力的考查,难度适中.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
15.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2L苯含有的分子数为0.5NA | |
| B. | 3.2gCH4含有的化学键数为0.4NA | |
| C. | 足量的O2与1molNa充分反应,转移的电子数为NA | |
| D. | 25℃时,1.0LpH=13的Ba(0H)2溶液中含有的0H-数为0.2NA |
15.下列说法正确的是( )
| A. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO-) | |
| C. | 浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3•H2O)+c(NH4+)=0.1mol/L | |
| D. | pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7 |
2.下列各表述与示意图一致的是( )
| A. | 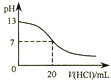 图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 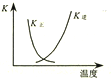 图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 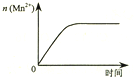 图③表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 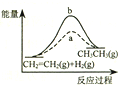 图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
19.下列各有机物中,属于烃的是( )
| A. | 氯丁烷 | B. | 苯 | C. | 硝基苯 | D. | 甘油 |
17.下列说法中正确的是( )
| A. | 由乙醇制乙烯是放热反应 | |
| B. | 氟氯代烷是一类含氟和含氯的卤代烃 | |
| C. | 木糖醇的结构简式为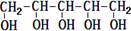 ,由此可见它能发生酯化反应,难溶于水 ,由此可见它能发生酯化反应,难溶于水 | |
| D. | 淀粉和纤维素的分子式都是(C6H10O5)n,所以二者是同分异构体 |
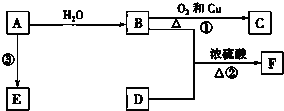 已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.
已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.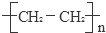 ,反应类型:加聚反应.
,反应类型:加聚反应.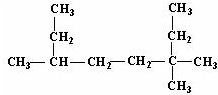 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷;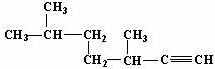 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔;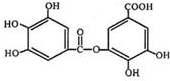 中含氧官能团的名称为羟基、羧基、酯基.
中含氧官能团的名称为羟基、羧基、酯基.