题目内容
反应CO(g)+H2O(g)?CO2(g)+H2(g)进行过程中的能量变化如图1所示.回答下列问题:
(1)该反应的△H= .
(2)在恒温恒压的条件下,向密闭容器中投入1molCO(g)、1molH2O(g),达到平衡时放出热量为a kJ;若条件不变,开始投入2molCO(g)、2molH2O(g),则达到平衡时放出热量为b kJ.下列关系正确的是 .
A.a>41,b=2a B.a=41,b>2a C.a<41,b=2a D.a<41,b<2a
(3)为探究外界条件对化学反应速度和化学平衡的影响,某同学在某固定容积的容器中进行了以下几组实验,记录如下表:
①第Ⅰ组实验中,反应进行到10min时,用CO的浓度变化表示的反应速率v(CO)= ;
②第Ⅱ组实验中,平衡时CO2的物质的量浓度c2= ;
③第Ⅲ组实验与实验Ⅰ相比,还隐含的条件是 ;
④根据图2第Ⅰ组实验c(CO2)随时间(t)的变化曲线,在答题卡上画出第Ⅴ组实验中c(CO2)随时间(t)的变化曲线.(图中要明确标出c5的数值)
⑤800℃时,向容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是 .
(4)碳与氧气不完全燃烧可以生成CO.已知3.6g碳与6.4g氧气完全反应,放出61.45kJ的热量,且碳的燃烧热为△H=-393.5kJ/mol,则碳与氧气反应生成CO的热化学方程式为 .

(1)该反应的△H=
(2)在恒温恒压的条件下,向密闭容器中投入1molCO(g)、1molH2O(g),达到平衡时放出热量为a kJ;若条件不变,开始投入2molCO(g)、2molH2O(g),则达到平衡时放出热量为b kJ.下列关系正确的是
A.a>41,b=2a B.a=41,b>2a C.a<41,b=2a D.a<41,b<2a
(3)为探究外界条件对化学反应速度和化学平衡的影响,某同学在某固定容积的容器中进行了以下几组实验,记录如下表:
| 组别 | 温度(℃) | 起始浓度(mol/L) | 反应达平衡时所需时间(min) | 平衡浓度(mol/L) c(CO2)或c(H2) | |
| c(CO) | c(H2O) | ||||
| Ⅰ | 800 | 1.00 | 1.00 | 10 | 0.50 |
| Ⅱ | 800 | 1.00 | 4.00 | t2 | c2 |
| Ⅲ | 800 | 1.00 | 1.00 | 1 | 0.50 |
| Ⅳ | 1000 | 1.00 | 1.00 | 8 | 0.40 |
| Ⅴ | 1000 | 2.00 | 2.00 | t5 | c5 |
②第Ⅱ组实验中,平衡时CO2的物质的量浓度c2=
③第Ⅲ组实验与实验Ⅰ相比,还隐含的条件是
④根据图2第Ⅰ组实验c(CO2)随时间(t)的变化曲线,在答题卡上画出第Ⅴ组实验中c(CO2)随时间(t)的变化曲线.(图中要明确标出c5的数值)
⑤800℃时,向容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是
(4)碳与氧气不完全燃烧可以生成CO.已知3.6g碳与6.4g氧气完全反应,放出61.45kJ的热量,且碳的燃烧热为△H=-393.5kJ/mol,则碳与氧气反应生成CO的热化学方程式为
考点:反应热和焓变,有关反应热的计算,探究浓度对化学平衡的影响,探究温度、压强对化学平衡的影响
专题:化学反应中的能量变化,化学平衡专题
分析:(1)△H=生成物的能量和-反应物的能量和,据此求算;
(2)在恒温恒压的条件下,只要加入反应物的物质的量之比相等,两反应等效;
(3)①v(CO)=
;
②相同温度下,化学平衡常数K相同,利用Ⅰ组反应数据求出K,结合三段式法求算;
③温度相同、反应物浓度相同、平衡浓度相同,反应又是在固定容积的容器中进行,达到平衡所用时间缩短,反应速率加快,可见是使用了催化剂;
④第Ⅴ组实验比第Ⅰ组实验的温度高,反应达到平衡所用时间短,Ⅳ与Ⅴ等效;
⑤据Qc<K时反应向正向移动;
(4)3.6g碳与6.4g氧气完全反应,说明生成的有0.2molCO和0.1molCO2,利用盖斯定律解答.
(2)在恒温恒压的条件下,只要加入反应物的物质的量之比相等,两反应等效;
(3)①v(CO)=
| △c(CO) |
| △t |
②相同温度下,化学平衡常数K相同,利用Ⅰ组反应数据求出K,结合三段式法求算;
③温度相同、反应物浓度相同、平衡浓度相同,反应又是在固定容积的容器中进行,达到平衡所用时间缩短,反应速率加快,可见是使用了催化剂;
④第Ⅴ组实验比第Ⅰ组实验的温度高,反应达到平衡所用时间短,Ⅳ与Ⅴ等效;
⑤据Qc<K时反应向正向移动;
(4)3.6g碳与6.4g氧气完全反应,说明生成的有0.2molCO和0.1molCO2,利用盖斯定律解答.
解答:
解:(1)△H=生成物能量和-反应物能量和=-41KJ/mol,故答案为:-41KJ/mol;
(2)在恒温恒压的条件下,只要加入反应物的物质的量之比相等,两反应等效,即各组分的百分含量相同,所以b=2a,反应可逆,反应物不可能完全转化,所以a<41,故答案为:C;
(3)①反应物生成物各物质的化学计量数之比为1:1:1:1,CO2的生成浓度为0.5mol/L,所以,10min内CO的浓度减少了0.5mol/L,c(CO)=
=0.05mol/(L?min),故答案为:0.05mol/(L?min);
②在①中,平衡时各物质浓度均为0.5mol/L,所以该温度下K=1,
CO(g)+H2O(g)?CO2(g)+H2(g)
反应前(mol/L) 1 4 0 0
反应了(mol/L) x x x x
平衡后(mol/L)1-x 4-x x x
=1,x=0.8mol/L,故答案为:0.8mol/L;
③温度相同、反应物浓度相同、平衡浓度相同,反应又是在固定容积的容器中进行,达到平衡所用时间缩短,反应速率加快,可见是使用了催化剂,故答案为:使用催化剂;
④第Ⅴ组实验比第Ⅰ组实验的温度高,反应达到平衡所用时间短,Ⅳ与Ⅴ等效,CO2的百分含量相同,Ⅴ中加入的反应物是Ⅳ的2倍,所以,其平衡浓度也是Ⅳ的2倍,为0.8mol/L,作图为:Ⅰ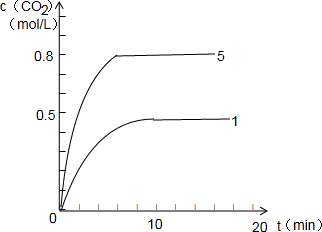 ,故答案为:
,故答案为: ;
;
⑤800℃时,K=1,若使反应正向进行,需要K<Qc,Qc=
>1,则x<3.0,故答案为:0≤x<3.0;
(4)3.6g碳与6.4g氧气完全反应,说明生成的有0.2molCO和0.1molCO2,C的燃烧热为△H=-393.5kJ/mol,则生成0.1molCO2放热39.35KJ,现在放出61.45kJ的热量,说明生成0.2molCO放热61.45KJ-39.35KJ=22.1KJ,生成2molCO放热221KJ,则C燃烧生成CO的热化学方程式为:2C(s)+O2(g)=2CO(g)△H=-221KJ/mol,故答案为:2C(s)+O2(g)=2CO(g)△H=-221KJ/mol.
(2)在恒温恒压的条件下,只要加入反应物的物质的量之比相等,两反应等效,即各组分的百分含量相同,所以b=2a,反应可逆,反应物不可能完全转化,所以a<41,故答案为:C;
(3)①反应物生成物各物质的化学计量数之比为1:1:1:1,CO2的生成浓度为0.5mol/L,所以,10min内CO的浓度减少了0.5mol/L,c(CO)=
| 0.5mol?L-1 |
| 10min |
②在①中,平衡时各物质浓度均为0.5mol/L,所以该温度下K=1,
CO(g)+H2O(g)?CO2(g)+H2(g)
反应前(mol/L) 1 4 0 0
反应了(mol/L) x x x x
平衡后(mol/L)1-x 4-x x x
| x?x |
| (1-x)?(4-x) |
③温度相同、反应物浓度相同、平衡浓度相同,反应又是在固定容积的容器中进行,达到平衡所用时间缩短,反应速率加快,可见是使用了催化剂,故答案为:使用催化剂;
④第Ⅴ组实验比第Ⅰ组实验的温度高,反应达到平衡所用时间短,Ⅳ与Ⅴ等效,CO2的百分含量相同,Ⅴ中加入的反应物是Ⅳ的2倍,所以,其平衡浓度也是Ⅳ的2倍,为0.8mol/L,作图为:Ⅰ
 ,故答案为:
,故答案为: ;
;⑤800℃时,K=1,若使反应正向进行,需要K<Qc,Qc=
| 1.0×3.0 |
| 1.0x |
(4)3.6g碳与6.4g氧气完全反应,说明生成的有0.2molCO和0.1molCO2,C的燃烧热为△H=-393.5kJ/mol,则生成0.1molCO2放热39.35KJ,现在放出61.45kJ的热量,说明生成0.2molCO放热61.45KJ-39.35KJ=22.1KJ,生成2molCO放热221KJ,则C燃烧生成CO的热化学方程式为:2C(s)+O2(g)=2CO(g)△H=-221KJ/mol,故答案为:2C(s)+O2(g)=2CO(g)△H=-221KJ/mol.
点评:本题考查范围广,题目难度大,特别注意影响化学反应速率以及影响平衡移动的条件的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )| A、苯在一定条件能发生取代反应 |
| B、苯能与H2发生加成反应 |
| C、邻二溴苯只有一种 |
| D、溴苯没有同分异构体 |
钋是原子序数最大的氧族元素,下列有关钋及钋的化合物的推测错误的是( )
| A、钋是第84号元素 |
| B、钋是能导电的固体 |
| C、钋的氢化物很稳定 |
| D、钋可能有两种不同价态的氧化物 |
关于核素10Be和9Be,下列说法正确的是( )
| A、是同一种原子 |
| B、具有相同的中子数 |
| C、具有相同的物理性质 |
| D、互为同位素 |

