题目内容
(1)相同温度下等物质量浓度的下列溶液中,
A、NH4Cl B、NH4HCO3 C、NH4HSO4 D、(NH4)2SO4
①pH值由大到小的顺序是 (用对应的字母填写)
②NH4+离子浓度由大到小的顺序是 (用对应的字母填写)
③若上述溶液的pH值相同,则其物质的量浓度关系是 (用对应的字母填写)
(2)向50mL 0.018mol?L-1的AgNO3溶液中加入50mL 0.020mol?L-1的盐酸,生成沉淀.已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)= .
②完全沉淀后,溶液的pH= .
A、NH4Cl B、NH4HCO3 C、NH4HSO4 D、(NH4)2SO4
①pH值由大到小的顺序是
②NH4+离子浓度由大到小的顺序是
③若上述溶液的pH值相同,则其物质的量浓度关系是
(2)向50mL 0.018mol?L-1的AgNO3溶液中加入50mL 0.020mol?L-1的盐酸,生成沉淀.已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=
②完全沉淀后,溶液的pH=
考点:盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)①题中NH4Cl和(NH4)2SO4水解都呈酸性,NH4HCO3水解呈碱性,NH4HSO4为酸式盐,HSO4-完全电离,溶液酸性最强;
②物质的量浓度相等的这几种溶液中,铵根离子水解程度较小,所以要比较铵根离子浓度大小,先比较盐中铵根离子的系数,系数越大,溶液中铵根离子浓度越大,相同系数的铵盐溶液,再根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可;
③若上述溶液的pH值相同,水解程度大的其浓度越小,水解程度越小的浓度越大分析;
(2)①反应前,n(Ag+)=0.018 mol?L-1×0.05 L=0.9×10-3 mol,
n(Cl-)=0.020 mol?L-1×0.05 L=1×10-3 mol;
反应后剩余的Cl-为0.1×10-3 mol,
则混合溶液中,c(Cl-)=1.0×10-3 mol?L-1,
c(Ag+)依据Ksp(AgCl)计算得到,
②溶液PH=-lgc(H+).
②物质的量浓度相等的这几种溶液中,铵根离子水解程度较小,所以要比较铵根离子浓度大小,先比较盐中铵根离子的系数,系数越大,溶液中铵根离子浓度越大,相同系数的铵盐溶液,再根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可;
③若上述溶液的pH值相同,水解程度大的其浓度越小,水解程度越小的浓度越大分析;
(2)①反应前,n(Ag+)=0.018 mol?L-1×0.05 L=0.9×10-3 mol,
n(Cl-)=0.020 mol?L-1×0.05 L=1×10-3 mol;
反应后剩余的Cl-为0.1×10-3 mol,
则混合溶液中,c(Cl-)=1.0×10-3 mol?L-1,
c(Ag+)依据Ksp(AgCl)计算得到,
②溶液PH=-lgc(H+).
解答:
解:(1)①NH4Cl和(NH4)2SO4对比,水解都呈酸性,(NH4)2SO4pH较小;NH4HCO3水解,碳酸氢根离子水解大于铵根离子水解程度,溶液呈碱性,pH最大;NH4HSO4为酸式盐,HSO4-完全电离,溶液酸性最强,则pH最小,溶液pH值由大到小的顺序是:B>A>D>C;
故答案为:B>A>D>C;
②D中铵根离子系数是2,A、B、C中铵根离子系数都是1,所以D比A、B、C的大,C中氢离子抑制铵根离子水解,B中碳酸氢根离子促进铵根离子水解,所以NH4+浓度由大到小的顺序为DCAB
故答案为:D>C>A>B;
③若上述溶液的pH值相同,水解程度大的其浓度越小,水解程度越小的浓度越大分析;上述分析可知,其物质的量浓度关系是C>D>A>B;
故答案为:C>D>A>B;
(2)①反应前,n(Ag+)=0.018 mol?L-1×0.05 L=0.9×10-3 mol,
n(Cl-)=0.020 mol?L-1×0.05 L=1×10-3 mol;
反应后剩余的Cl-为0.1×10-3 mol,
则混合溶液中,c(Cl-)=1.0×10-3 mol?L-1,
c(Ag+)=Ksp(AgCl)/c(Cl-)=1.0×10-7 mol?L-1.
故答案为:1.0×10-7 mol?L-1;
②H+没有参与反应,完全沉淀后,c(H+)=0.010 mol?L-1,pH=2,故答案为:2.
故答案为:B>A>D>C;
②D中铵根离子系数是2,A、B、C中铵根离子系数都是1,所以D比A、B、C的大,C中氢离子抑制铵根离子水解,B中碳酸氢根离子促进铵根离子水解,所以NH4+浓度由大到小的顺序为DCAB
故答案为:D>C>A>B;
③若上述溶液的pH值相同,水解程度大的其浓度越小,水解程度越小的浓度越大分析;上述分析可知,其物质的量浓度关系是C>D>A>B;
故答案为:C>D>A>B;
(2)①反应前,n(Ag+)=0.018 mol?L-1×0.05 L=0.9×10-3 mol,
n(Cl-)=0.020 mol?L-1×0.05 L=1×10-3 mol;
反应后剩余的Cl-为0.1×10-3 mol,
则混合溶液中,c(Cl-)=1.0×10-3 mol?L-1,
c(Ag+)=Ksp(AgCl)/c(Cl-)=1.0×10-7 mol?L-1.
故答案为:1.0×10-7 mol?L-1;
②H+没有参与反应,完全沉淀后,c(H+)=0.010 mol?L-1,pH=2,故答案为:2.
点评:本题考查了盐类水解的分析判断,溶液酸碱性和PH大小比较,溶度积常数计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
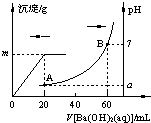 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点对应溶液的pH:a=1 |
| B、生成沉淀的最大质量m=2.33g |
| C、原混合液中c(HCl)=0.2mol?L-1 |
| D、当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
关于下列装置图的叙述正确的是( )
A、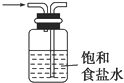 是洗气装置,除去氯气中的氯化氢 |
B、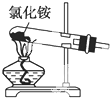 制取氨气 |
C、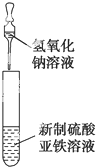 可用于制备氢氧化亚铁并观察其颜色 |
D、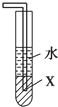 中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
为防止有机物挥发,可加一层水保存,即水封.下列有机物中,既能用水封法保存,又能发生水解和消去反应的是( )
| A、乙醇 | B、一溴乙烷 |
| C、乙酸乙酯 | D、四氯化碳 |
某小组利用下列装置进行电化学实验,盐桥中填充琼脂及饱和KNO3溶液,下列说法正确的是( )
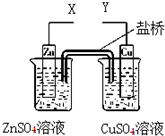

A、若X和Y与电流表 连接,则电流方向:锌电极→ 连接,则电流方向:锌电极→ →铜电极 →铜电极 |
B、若X和Y与电流表 连接,盐桥中的K+向左边烧杯移动 连接,盐桥中的K+向左边烧杯移动 |
| C、若X和Y分别与电源“-”、“+”极相连,Cu极发生氧化反应 |
| D、若X和Y分别与电源“-”、“+”极相连,Zn极质量减轻 |
下列说法正确的是( )
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④除去Cl2气体中的HCl,可将气体通入饱和食盐水
⑤检验HCl气体中是否混有Cl2的方法是将气体通入硝酸银溶液.
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④除去Cl2气体中的HCl,可将气体通入饱和食盐水
⑤检验HCl气体中是否混有Cl2的方法是将气体通入硝酸银溶液.
| A、①②③ | B、②③④ | C、③④ | D、③ |
下列各组有机物中,不能用酸性高锰酸钾溶液鉴别的是( )
| A、丁烷、1,3-丁二烯 |
| B、苯、己烯 |
| C、己烷、环己烯 |
| D、乙烯、丙炔 |