题目内容
8.聚合氯化铁铝(简称PAFC),其化学通式为:[Fe2Al3(OH)aClb•zH2O]m.某同学为测定其组成,进行如下实验:①准确称取4.5050g样品,溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到2.3300g固体.②另准确称取等质量样品溶于水,在溶液中加入适量Zn粉和稀硫酸,将Fe3+完全还原为Fe2+.用0.1000mol•L-1标准KMnO4溶液滴定Fe2+,消耗标准溶液的体积为20.00mL.③另准确称取等质量样品,用硝酸溶解后,加入足量AgNO3溶液,得到4.3050g白色沉淀.(1)若滴定管在使用前未用标准溶液润洗,测得的Al3+含量将偏低(填“偏高”、或“偏低”或“不变”).
(2)实验室检验Fe3+常用的方法是向待测液中加入KSCN溶液,如果溶液变为红色,即可证明溶液中含有铁离子.
(3)通过计算确定PAFC的化学式[Fe2Al3(OH)9Cl3•3H2O]m(写出计算过程,m为聚合度,不必求出).
分析 (1)若滴定管在使用前未用标准溶液润洗,相当于用的标准液的浓度偏小,所以用到的体积偏高,测得待测液中亚铁离子的浓度偏大,即铁离子偏大;
(2)实验室检验某溶液是否含有Fe3+,常用的试剂为硫氰化钾溶液,根据溶液是否变成红色,证明溶液中是否存在铁离子;
(3)①称取样品溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到2.3300g固体是氧化铝和氧化铁;
②另准确称取等质量样品溶于水,在溶液中加入适量Zn粉和稀硫酸,将Fe3+完全还原为Fe2+,用0.1000mol•L-1标准KMnO4溶液滴定Fe2+,消耗标准溶液的体积为20.00mL,根据KMnO4~5Fe2+~5Fe3+,可以计算铁离子的量,根据①结合元素守恒计算Al元素的含量;
③另准确称取等质量样品,用硝酸溶解后,加入足量AgNO3溶液,得到4.3050g白色沉淀即AgCl沉淀,可以计算Cl元素的量.
解答 解:(1)若滴定管在使用前未用标准溶液润洗,相当于用的标准液的浓度偏小,所以用到的体积偏高,测得待测液中亚铁离子的浓度偏大,即铁离子偏大,测得的Al3+含量将偏低,故答案为:偏低;
(2)铁离子能够与硫氰根离子反应生成红色的络合物硫氰化铁,据此检验铁离子是否存在,所以检验铁离子是否存在的最简便的方法为:向待测液中加入KSCN溶液,如果溶液变为红色,即可证明溶液中含有铁离子,
故答案为:向待测液中加入KSCN溶液,如果溶液变为红色,即可证明溶液中含有铁离子;
(3)①称取样品溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到2.3300g固体是氧化铝和氧化铁;②另准确称取等质量样品溶于水,在溶液中加入适量Zn粉和稀硫酸,将Fe3+完全还原为Fe2+,用0.1000mol•L-1标准KMnO4溶液滴定Fe2+,消耗标准溶液的体积为20.00mL,根据KMnO4~5Fe2+~5Fe3+,则Fe3+的物质的量是0.5×20×10-3mol=0.01mol,氧化铁的质量是0.01mol×0.5×160g/mol=0.8g,氧化铝质量=2.33g-0.8g=1.53g,所以
Al3+的物质的量是0.03mol,
③另准确称取等质量样品,用硝酸溶解后,加入足量AgNO3溶液,得到4.3050g白色沉淀即AgCl沉淀,物质的量是$\frac{4.3050g}{143.5g/mol}$=0.03mol,所以可以计算Cl元素的物质的量是:0.03mol.根据电荷守恒:3n(Fe3+)+3n(Al3+)=n(Cl-)+n(OH-),所以n(OH-)=0.01mol×3+0.03mol×3-0.03mol=0.09mol,
n(H2O)=$\frac{4.5050-m(F{e}^{3+})-m(A{l}^{3+})-m(C{l}^{-})-m(O{H}^{-})}{18g/mol}$=0.03mol,
综上可知:n(Fe3+):n(Al3+):n(Cl-):n(OH-):n(H2O)=1:3:3:9:3,所以PAFC的化学式为:[FeAl3(OH)9Cl3•3H2O]m.
答:PAFC的化学式为[FeAl3(OH)9Cl3•3H2O]m.
点评 本题考查学生物质分子式的确定知识,注意物质的性质以及元素守恒、电荷守恒的应用是解题的关键,难度很大.

| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
| A. | 反应起始时速率:X=Y | B. | 反应消耗镁的量:X<Y | ||
| C. | 产生H2量:X>Y | D. | 反应片刻后速率:X>Y |
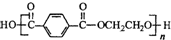 ,外用材料是纯羊毛线.则下列有关说法不正确的是( )
,外用材料是纯羊毛线.则下列有关说法不正确的是( )| A. | 羊毛的主要成分属于蛋白质 | |
| B. | 涤纶属于天然高分子化合物 | |
| C. | 合成涤纶的单体之一可以是HOCH2CH2OH | |
| D. | 可用灼烧的方法区别羊毛和涤纶 |
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
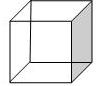 “立方烷”是一祌新合成的烃,其分子为正立方体结构,其碳架结构如图所示
“立方烷”是一祌新合成的烃,其分子为正立方体结构,其碳架结构如图所示 .
.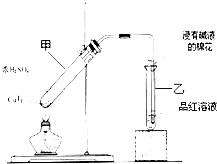 某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请回答下列问题:
某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请回答下列问题: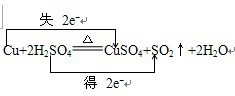 .
.