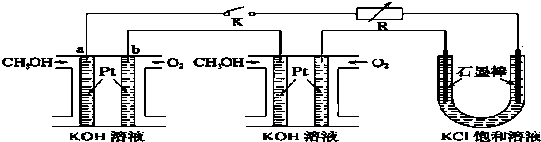
题目内容
下列表格中烷烃的一氯代物只有一种,仔细分析其结构和组成的变化规律,判断第4位烷烃的分子式是( )
 | 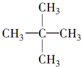 | 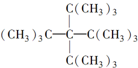 | … |
| 1 | 2 | 3 | … |
| A、C53H108 |
| B、C36H72 |
| C、C53H106 |
| D、C36H70 |
考点:有机物实验式和分子式的确定
专题:有机物分子组成通式的应用规律
分析:依据题意推出,第3位烷烃分子中氢原子被甲基取代,得到第4位烷烃.
解答:
解:依据题意推出,第3位烷烃分子中氢原子被甲基取代,第3位氢原子个数为36,故第4位烷烃含甲基36个,含氢36×3=108,含碳
=53,得到第4位烷烃分子式为C53H108,故选A.
| 108-2 |
| 2 |
点评:本题考查了有机物结构的变化规律,中等难度,找出相邻烃的变化特点是解题关键.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
下列过程中,涉及化学变化的是( )
| A、三氯化铁溶液滴入沸水中制胶体 |
| B、氯化钠溶于水 |
| C、过滤除去粗盐中的不溶性杂质 |
| D、蒸馏法将海水淡化为饮用水 |
今有一混合物的水溶液,含有以下离子中的若干种:Na+、NH4+、Cl-、Ba2+、HCO3-、SO42-,现取两份100m L的该溶液进行如下实验:
(1)第一份加足量NaOH溶液,加热,收集到标准状况下的气体448mL;
(2)第二份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,下列推测正确的是( )
(1)第一份加足量NaOH溶液,加热,收集到标准状况下的气体448mL;
(2)第二份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,下列推测正确的是( )
| A、Ba2+一定存在 |
| B、100mL该溶液中含0.01mol HCO3- |
| C、Na+不一定存在 |
| D、Cl-不确定,可向原溶液中加入AgNO3溶液进行检验 |
欲在金属表面镀银,应把镀件挂在电镀池的阴极.下列各组中,选用的阳极金属和电镀液均正确的是( )
| A、Ag和AgCl溶液 |
| B、Ag和AgNO3溶液 |
| C、Pt和Ag2CO3溶液 |
| D、Pt和Ag2SO4溶液 |
用惰性电极实现电解,下列说法正确的是( )
| A、电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
| B、电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为2:1 |
| D、电解氯化铜溶液,在阴极上和阳极上析出产物的质量之比为71:64 |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1 min内的平均速率为v(H2)=
| ||
| B、保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.30 mol | ||
| C、保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | ||
| D、温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |