题目内容
14.已知反应A+B═C+D为放热反应,对该反应的下列说法正确的是( )| A. | A的能量一定高于C | |
| B. | A和B的总能量一定低于C和D的总能量 | |
| C. | A和B的总能量一定高于C和D的总能量 | |
| D. | 该反应为放热反应,故不必加热就一定能发生 |
分析 反应吸放热与反应物和生成物的总能量的相对大小有关,与反应条件无关,即反应物总能量高于生成物总能量则放热,否则为吸热反应.据此分析.
解答 解:反应A+B═C+D为放热反应,只能说明A和B的总能量大于C和D的总能量,或是断开A和B中的化学键所吸收的能量小于形成C和D中的化学键所放出的能量,故A/B错误,C正确;反应吸放热与反应条件无关,即放热反应不一定不需要加热,需要加热的不一定是吸热反应,故D错误.
故选C.
点评 本题主要考查的是放热反应与吸热反应的定义,注意放热反应与反应物和生成物的总能量的关系,难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案
相关题目
4.下列物质中属于弱电解质的是( )
| A. | 醋酸 | B. | 氨 | C. | 碳酸氢钠 | D. | NaOH溶液 |
5.下列过程有热量放出的是( )
| A. | 断开氢气中的H-H键 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | C与H2O(g)反应 | D. | Na与H2O反应 |
9.已知1mol烷烃裂化时一般可以裂化成1mol烷烃和1mol烯烃,丁烷催化裂化时有两种不同的裂化方式,如果有90%的丁烷发生裂化,且裂化生成的两种烯烃的质量相等,则裂化后得到的混和气体中分子量最小的气体在混和气体中的体积百分含量约是( )
| A. | 11% | B. | 19% | C. | 40% | D. | 50% |
19.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 7.8 g Na2O2与足量水反应转移的电子数为0.2NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 常温常压下,1 mol CH4中含有的氢原子数为4NA | |
| D. | 12.0 g熔融的NaHSO4中含有0.1NA个Na+、0.1NA个H+和0.1NA个SO42- |
4.葡萄糖在人体内发生的主要化学反应是( )
| A. | 加成反应 | B. | 聚合反应 | C. | 水解反应 | D. | 氧化反应 |
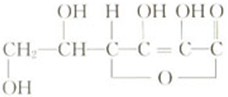 维生素C的结构式如下,
维生素C的结构式如下,