题目内容
11.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)在以上元素的原子中,形成化合物种类最多的是(填元素符号)C.
(2)地壳中含量居于第二位的元素在周期表中的位置是第三周期第IVA族.
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式
 或
或 .
.(4)W是第五周期与④同主族的元素.据此推测W不可能具有的性质是BD.
A.最高正化合价为+6价
B.气态氢化物比H2S稳定
C.最高价氧化物的水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
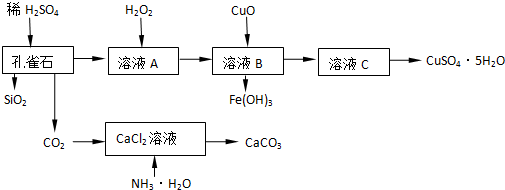
(5)如图乙,由元素⑥、⑧形成的物质X与由元素①、③形成的化合物Y可发生以下反应:X溶液与Y溶液反应的离子方程式Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,M中阳离子的鉴定方法:取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
分析 由元素在周期表的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)碳元素形成的有机物种类最多;
(2)地壳中含量居于第二位的元素为Si;
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物有NaOH、Na2O2;
(4)W是第五周期与④同主族的元素,为氧族元素,最高价为+6价,同主族从上到下非金属性减弱;
(5)M是仅含非金属的盐所以一定是铵盐;Z$\stackrel{△}{→}$N→⑥的单质.根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝,Z是氢氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知XY是铝盐和一水合氨的反应.
解答 解:由元素在周期表的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)C元素形成的有机物种类最多,故答案为:C;
(2)地壳中含量居于第二位的元素为Si,在周期表中的位置是第三周期第IVA族,故答案为:第三周期第IVA族;
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物有NaOH、Na2O2,其中一种化合物的电子式为 或
或 ,
,
故答案为: 或
或 ;
;
(4)W是第五周期与④同主族的元素,为氧族元素,则
A.最外层电子数为6,则最高正化合价为+6价,故A正确;
B.非金属性比S的弱,则气态氢化物不如H2S稳定,故B错误;
C.非金属性比S的弱,则最高价氧化物的水化物的酸性比硫酸弱,故C正确;
D.非金属性较弱,则单质在常温下不能与氢气化合,故D错误;
故答案为:BD;
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生如图转化的反应,其中M是仅含非金属的盐,所以一定是铵盐;Z$\stackrel{△}{→}$N→⑥的单质,根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝电解生成金属铝,Z是氢氧化铝受热分解生成氧化铝,结合反应:X+Y+H2O→Al(OH)3+NH4+可知XY是铝盐和一水合氨的反应,则X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,M中阳离子的鉴定方法为取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识、元素周期律为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案| A. | H2O和Na2O | B. | MgF2和NaCl | C. | SO2和CaO2 | D. | NH3和MgCl2 |
| A. | 同温同压下,VLCO和H2的混合气体,完全燃烧消耗O2的体积为$\frac{V}{2}$L | |
| B. | 已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则可求出此溶液中氢氧化钠的质量分数 $\frac{2000}{20+9a}$% | |
| C. | 4.2g氮气和4.8g某单质RX所含原子个数相同,且分子个数之比为1:1,则R的相对原子质量为16 | |
| D. | 在10%的NaOH溶液中,平均每9个水分子溶有1个OHˉ |
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④HCl的还原性比H2S强
⑤HClO的酸性比H2SO4强
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
⑦Cl2能与H2S反应生成S
⑧还原性:Cl-<S2-.
| A. | ③④⑤⑦⑧ | B. | ③⑥⑦ | C. | ③⑥⑦⑧ | D. | ①②③④⑤⑥⑦⑧ |
| A. | 金属元素原子最外层电子数越少,该金属失电子能力越强 | |
| B. | 铅位于周期表中金属和非金属的交界处,可作半导体材料 | |
| C. | aA2+、bB+、cC3-三种离子具有相同的电子层结构,则原子序数c>a>b | |
| D. | 若存在简单阴离子R2-,则R一定位于ⅥA族 |
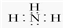 ;
; ;
; ;它的一种同素异形体是O3.(写化学式)
;它的一种同素异形体是O3.(写化学式)