题目内容
硝酸是常见的三大强酸之一,在化学研究和化工生产中有着广泛应用,常用于制备硝酸盐、染料、肥料、医药中间体、烈性炸药等.硝酸盐多用于焰火、试剂、图象处理行业.
(1)某金属M的硝酸盐受热时按下式分解:2MNO3→2M+2NO2↑+O2↑,加热3.40g MNO3,生成NO2和O2折算成标准状况时的总体积为672mL.由此可以计算出M的相对原子质量为 .
(2)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2L.其中NO的体积为 .
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(S.T.P.).则产物中硝酸铜的物质的量为 .如原混合物中有0.01molCu,则其中Cu2O与CuO的质量比为 .
(4)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,HNO3被还原成NO,待反应结束后,可产生标准状况下的气体多少升?(写出计算过程)
(1)某金属M的硝酸盐受热时按下式分解:2MNO3→2M+2NO2↑+O2↑,加热3.40g MNO3,生成NO2和O2折算成标准状况时的总体积为672mL.由此可以计算出M的相对原子质量为
(2)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2L.其中NO的体积为
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(S.T.P.).则产物中硝酸铜的物质的量为
(4)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,HNO3被还原成NO,待反应结束后,可产生标准状况下的气体多少升?(写出计算过程)
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据n=
计算混合气体总物质的量,再根据方程式计算MNO3的物质的量,根据M=
计算MNO3的摩尔质量,进而计算M的相对原子质量;
(2)设NO和NO2的物质的量分别为xmol、ymol,根据电子转移守恒及二者体积列方程计算,再根据V=nVm计算NO的体积;
(3)混合物与硝酸恰好反应,溶液中溶质为硝酸铜,根据N元素守恒:2n[Cu(NO3)2]+n(NO)=n(HNO3),据此计算硝酸铜的物质的量;
令Cu2O与CuO的物质的量分别为a mol、b mol,根据Cu元素守恒、电子转移守恒列方程计算,再根据m=nM计算;
(4)根据n=cV计算n(H+)、n(NO3-),由于Fe过量,发生反应:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,进行过量计算,根据不足量的物质计算NO的物质的量,再根据V=nVm计算NO的体积.
| V |
| Vm |
| m |
| n |
(2)设NO和NO2的物质的量分别为xmol、ymol,根据电子转移守恒及二者体积列方程计算,再根据V=nVm计算NO的体积;
(3)混合物与硝酸恰好反应,溶液中溶质为硝酸铜,根据N元素守恒:2n[Cu(NO3)2]+n(NO)=n(HNO3),据此计算硝酸铜的物质的量;
令Cu2O与CuO的物质的量分别为a mol、b mol,根据Cu元素守恒、电子转移守恒列方程计算,再根据m=nM计算;
(4)根据n=cV计算n(H+)、n(NO3-),由于Fe过量,发生反应:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,进行过量计算,根据不足量的物质计算NO的物质的量,再根据V=nVm计算NO的体积.
解答:
解:(1)NO2和O2折算成标准状况时的总体积为672mL,气体总物质的量=
=0.03mol,由方程式可知,MNO3的物质的量=0.03mol×
=0.02mol,故MNO3的摩尔质量=
=170g/mol,则M的相对原子质量=170-62=108,故答案为:108;
(2)32.64g铜的物质的量=
=0.51mol,NO和NO2的总物质的量=
=0.5mol,设NO和NO2的物质的量分别为xmol、ymol,根据电子转移守恒及二者物质的量,则:
解得x=0.26 y=0.24
故标况下,NO的体积=0.26mol×22.4L/mol=5.824L;
(3)NO的物质的量=
=0.01mol,
混合物与硝酸恰好反应,溶液中溶质为硝酸铜,根据N元素守恒:2n[Cu(NO3)2]+n(NO)=n(HNO3),所以n[Cu(NO3)2]=
×(0.1L×0.6mol/L-0.01mol)=0.025mol;
令Cu2O与CuO的物质的量分别为a mol、b mol,根据Cu元素守恒、电子转移守恒,则:
解得a=0.005 b=0.005
故Cu2O与CuO的质量比=144g/mol:80g/mol=9:5,
故答案为:0.025;9:5;
(4)n(H+)=0.01L×4mol/L×2+0.01L×2mol/L=0.1mol,n(NO3-)=0.01L×2mol/L=0.02mol
由于Fe过量,发生反应:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,0.02molNO3-完全反应,需要H+的物质的量=0.02mol×
=0.08mol<0.1mol,故H+过量,NO3-不足,故生成NO的物质的量=0.02mol,则标况下,NO的体积=0.02mol×22.4L/mol=0.448L,
答:可产生标准状况下的气体为0.448L.
| 0.672L |
| 22.4L/mol |
| 2 |
| 3 |
| 3.4g |
| 0.02mol |
(2)32.64g铜的物质的量=
| 32.64g |
| 64g/mol |
| 11.2L |
| 22.4L/mol |
|
解得x=0.26 y=0.24
故标况下,NO的体积=0.26mol×22.4L/mol=5.824L;
(3)NO的物质的量=
| 0.224L |
| 22.4L/mol |
混合物与硝酸恰好反应,溶液中溶质为硝酸铜,根据N元素守恒:2n[Cu(NO3)2]+n(NO)=n(HNO3),所以n[Cu(NO3)2]=
| 1 |
| 2 |
令Cu2O与CuO的物质的量分别为a mol、b mol,根据Cu元素守恒、电子转移守恒,则:
|
解得a=0.005 b=0.005
故Cu2O与CuO的质量比=144g/mol:80g/mol=9:5,
故答案为:0.025;9:5;
(4)n(H+)=0.01L×4mol/L×2+0.01L×2mol/L=0.1mol,n(NO3-)=0.01L×2mol/L=0.02mol
由于Fe过量,发生反应:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,0.02molNO3-完全反应,需要H+的物质的量=0.02mol×
| 8 |
| 2 |
答:可产生标准状况下的气体为0.448L.
点评:本题考查化学方程式计算、混合物计算,属于拼合型题目,侧重考查学生分析计算能力,题目计算量较大,为易错题目,难度中等.

练习册系列答案
相关题目

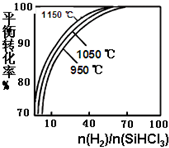 粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g)?Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g)?Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;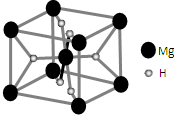 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向. 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.