题目内容
15.下列描述或表达式正确的是( )| A. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中1molMnO2被氧化转移2mol电子 | |
| B. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| C. | NaHSO4在熔融状态下的电离方程式为:NaHSO4═Na++HSO4- | |
| D. | 需要通电才可进行的有:电解、电泳、电离、电镀、电化腐蚀 |
分析 A.Mn元素的化合价降低,被还原;
B.难溶性的盐,溶解的部分能全部电离;
C.酸式盐在熔融时电离出金属阳离子和酸式盐的酸根离子;
D.电离是在水的作用或熔融时发生的.
解答 解:A.反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中Mn元素的化合价降低,被还原,则1molMnO2被还原转移2mol电子,故A错误;
B.难溶性的盐,溶解的部分能全部电离,所以CaCO3、BaSO4等都是强电解质,故B错误;
C.酸式盐在熔融时电离出金属阳离子和酸式盐的酸根离子,则NaHSO4在熔融状态下的电离方程式为:NaHSO4═Na++HSO4-,故C正确;
D.电离是在水的作用或熔融时发生的,所以电离不需要通电,原电池原理的电化学腐蚀也不需要通电,电解原理形成的电化学腐蚀需要通电,故D错误.
故选C.
点评 本题考查了氧化还原反应、电解质强弱的判断、电解质电离方程式的书写等,题目难度不大,侧重于基础知识的考查,注意把握有关的基础知识.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.常见的无机酸25℃时在水溶液中的电离平衡常数如下表,下列选项正确的是( )
| 氢氰酸(HCN) | 碳酸(H2CO3) | 氢氟酸(HF) |
| K=6.2×10-10 | Ka1=4.2×10-7 | K=6.61×10-4 |
| A. | 氟化钠溶液中通入CO2:2F-+H2O+CO2═2HF+CO32- | |
| B. | NaCN与HCN的混合溶液中:2c(Na+)═c(CN-)+c(HCN) | |
| C. | 0.2 mol•L-1 HCN溶液与0.1mol•L-1NaOH溶液等体积混合后,溶液的pH>7 | |
| D. | 25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者 |
10.除去下列物质中少量杂质的方法正确的是( )
| A. | 除去CO2中混有的HCl:用碳酸钠溶液洗气 | |
| B. | 通过碱石灰固体除去SO2中的水蒸气 | |
| C. | 除去氯化钠中混有的氯化铵:用加热法 | |
| D. | 除去NaHCO3中混有的Na2CO3:用加热法 |
7.下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是( )
| A. | N2和H2 | B. | Na和O2 | C. | NaOH和CO2 | D. | C和O2 |
4.某温度下,反应2SO2(g)+O2(g)═2SO3(g)的平衡常数为K°,则同一温度下.反应SO3(g)═SO2(g)+$\frac{1}{2}$O2(g)的平衡常数为( )
| A. | $\frac{1}{({K}^{°})^{\frac{1}{2}}}$ | B. | $\frac{{K}^{°}}{2}$ | C. | $\frac{1}{{K}^{°}}$ | D. | 2K° |
9.汽油在常温下为无色至淡黄色的液体,为常用的有机溶剂,难溶于水,密度为0.78g/cm3.将碘水倒入汽油中,振荡,静置,下列现象描述正确的是( )
| A. | 汽油在上层,水在下层,水层无色 | B. | 汽油在下层,水在上层,汽油紫色 | ||
| C. | 汽油在上层,水在下层,汽油层无色 | D. | 汽油在下层,水在下层,汽油紫色 |
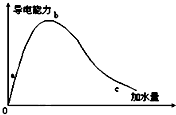 在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力如图所示,请回答: