题目内容
10.除去下列物质中少量杂质的方法正确的是( )| A. | 除去CO2中混有的HCl:用碳酸钠溶液洗气 | |
| B. | 通过碱石灰固体除去SO2中的水蒸气 | |
| C. | 除去氯化钠中混有的氯化铵:用加热法 | |
| D. | 除去NaHCO3中混有的Na2CO3:用加热法 |
分析 A.二者都与氢氧化钠溶液反应;
B.二者都可被碱石灰吸收;
C.氯化铵不稳定,加热易分解;
D.碳酸氢钠不稳定,加热易分解.
解答 解:A.二者都与氢氧化钠溶液反应,应用饱和碳酸氢钠溶液除杂,故A错误;
B.二者都可被碱石灰吸收,应用浓硫酸敢做,故B错误;
C.氯化铵不稳定,加热易分解,可用加热法除杂,故C正确;
D.碳酸氢钠不稳定,加热易分解,如在溶液中,应通入二氧化碳除杂,故D错误.
故选C.
点评 本题考查物质的分离与除杂,为高考常见题型,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键,难度不大.

练习册系列答案
相关题目
18.一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应,2SO2(g)+O2(g)?2SO3(g).反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1min内的平均速率为v(SO3)=0.088/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10molSO3和0.010molO2,到达平衡时,n(SO2)=0.012mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率大于88% |
5.U常见化合价有+4和+6,硝酸铀酰[UO2(NO3)2]加热可发生如下分解反应:UO2(NO3)2→UxOY+NO2↑+O2↑(未配平),在600K时,将气体产物收集于试管中并倒扣于水中气体全部被吸收,水充满试管.则生成的铀的氧化物化学式是( )
| A. | UO3 | B. | UO2 | C. | 2UO2•UO3 | D. | UO2•2UO3 |
15.下列描述或表达式正确的是( )
| A. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中1molMnO2被氧化转移2mol电子 | |
| B. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| C. | NaHSO4在熔融状态下的电离方程式为:NaHSO4═Na++HSO4- | |
| D. | 需要通电才可进行的有:电解、电泳、电离、电镀、电化腐蚀 |
19.如图是利用细菌处理污水并发电的装置示意图,已知A室电极上吸附有大量的细菌,B室在工作过程中需不断补充新鲜空气,污水中的有机物以C6H10O5表示.下列说法错误的是( )


| A. | A极上发生类似C6H10O5-24e+7H2O═6CO2↑+24H+的电极反应 | |
| B. | B极上发生的是还原反应,工作过程中电极周围溶液的pH增大 | |
| C. | 工作过程中外电路的电子由A极流向B极,溶液中则由B极流向A极 | |
| D. | 污水中所存在的阳离子经离子交换膜由A室流向B室. |
 2N02 △H<0中N0的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)﹤v(逆)的点是 ( )
2N02 △H<0中N0的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)﹤v(逆)的点是 ( )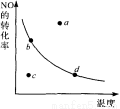
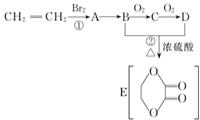 由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)
由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)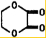 +2H2O.
+2H2O.