题目内容
16.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 46g乙醇中含有共价键的数目为7NA | |
| B. | 50ml 2mol•L-1NaClO溶液中ClO-数目为0.1NA | |
| C. | 标准状况下,5.6gFe与足量的浓硫酸充分反应,转移电子数为0.2NA | |
| D. | 常温常压下,4.4g由CO2和N2O组成的混合气体所含原子总数为0.3NA |
分析 A、求出乙醇的物质的量,然后根据乙醇中含8条共价键来分析;
B、次氯酸跟为弱酸根,在溶液中会水解;
C、在标况下,铁在浓硫酸中会钝化;
D、CO2和N2O的摩尔质量均为44g/mol,且均为三原子分子.
解答 解:A、46g乙醇的物质的量为n=$\frac{46g}{46g/mol}$=1mol,而乙醇中含8条共价键,故1mol乙醇中含8mol共价键即8NA个,故A错误;
B、次氯酸跟为弱酸根,在溶液中会水解,故溶液中的次氯酸根的个数小于0.1NA个,故B错误;
C、在标况下,铁在浓硫酸中会钝化,故不能反应完全,则转移的电子数小于0.2NA个,故C错误;
D、CO2和N2O的摩尔质量均为44g/mol,故4.4g混合物的物质的量为0.1mol,且两者均为三原子分子,故0.1mol混合物中含0.3mol原子即0.3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.化学叙述中错误的是( )
| A. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 | |
| B. | 金属钠着火时不能使用泡沫灭火器灭火 | |
| C. | 因为NH4Cl受热易分解,实验室应保存在棕色试剂瓶中 | |
| D. | 铁粉作食品袋内的脱氧剂,起还原作用 |
7.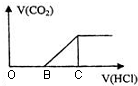 向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图.则下列分析正确的是(不计CO2溶解)( )
向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图.则下列分析正确的是(不计CO2溶解)( )
 向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图.则下列分析正确的是(不计CO2溶解)( )
向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图.则下列分析正确的是(不计CO2溶解)( )| A. | 若OB=0,则溶液M为Na2CO3溶液 | |
| B. | 若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2→HCO3- | |
| C. | 若溶液M中c(NaHCO3)=2c(Na2CO3),则3OB=BC | |
| D. | 若溶液M中大量存在的阴离子为CO32-和HCO3-,则OB>BC |
4.下列说法正确的是( )
| A. | SiO2、CO2 都是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应的产物相同 | |
| C. | SO2、NO、CO2都是大气污染物,在空气中都能稳定存在 | |
| D. | HCl、HNO3都是强酸,和FeO的反应都属于复分解反应 |
11.用如图所示装置进行实验,下列对实验现象的解释不合理的是( )
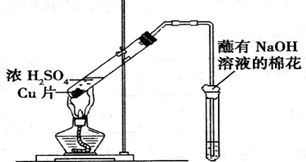

| 试管中试剂 | 试管中现象 | 解 释 | |
| A | 硝酸酸化的BaCl2溶液 | 生成白色沉淀 | 白色沉淀为BaSO3 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2水溶液显酸性 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
1.已知测定中和热的实验步骤如下:①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度;②量取50mL 0.55mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:
(1)NaOH溶液稍过量的原因确保硫酸被完全中和.
(2)加入NaOH溶液的正确操作是B (填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是用套在温度计上的环形玻璃搅拌棒轻轻地搅动.
(4)设溶液的密度均为1g•cm-3,中和后溶液的比热c=4.18J•(g•℃)-1,请根据实验数据求出中和热为56.85kJ/mol,写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O△H=-113.7kJ/mol.
(1)NaOH溶液稍过量的原因确保硫酸被完全中和.
(2)加入NaOH溶液的正确操作是B (填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是用套在温度计上的环形玻璃搅拌棒轻轻地搅动.
(4)设溶液的密度均为1g•cm-3,中和后溶液的比热c=4.18J•(g•℃)-1,请根据实验数据求出中和热为56.85kJ/mol,写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O△H=-113.7kJ/mol.
| 温度实验次数 | 起始温度t2 /℃ | 终止温度 t2 /℃ | 温度差平均值 (t2- t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
8.某无色混合气体中可能含有Cl2、SO2、NO、NO2、CO2 中的两种或多种气体.现将此无色的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成分的判断正确的是( )
| A. | 一定有Cl2 | B. | 一定有SO2 和NO | ||
| C. | 可能有NO2 | D. | 一定有SO2,可能有NO |
6.出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面.下列说法不正确的是( )
| A. | 将金属制成合金,可以保持甚至强化单一金属的长处,克服其不足 | |
| B. | 在自然环境中,锡青铜中的锡对铜起保护作用 | |
| C. | 锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 | |
| D. | 生成Cu2(OH)3Cl覆盖物是化学反应过程,但不是电化学腐蚀过程 |
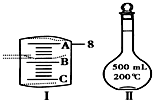 实验室要用NaCl晶体配制500mL 0.2mol•L-1NaCl溶液,回答下列问题:
实验室要用NaCl晶体配制500mL 0.2mol•L-1NaCl溶液,回答下列问题: