题目内容
16.某温度下,浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,该溶液呈中性的依据是( )| A. | a=b | B. | HA与BOH的电离常数相等 | ||
| C. | 混合溶液中,c(H+)=$\sqrt{{K}_{W}}$mol/L | D. | 混合溶液中,c(H+)+c(B+)═c(OH-)+c(A-) |
分析 溶液中c(H+)=c(OH-)时,溶液一定呈中性,据此分析.
解答 解:A.浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,若a=b,则恰好反应生成盐,但是盐溶液不一定显中性,故A错误;
B.HA与BOH的电离常数相等,则二者等物质的量恰好反应时溶液显中性,但是,ab的关系不知道,无法确是否显中性,故B错误;
C.Kw=c(H+)×c(OH-),当c(H+)=$\sqrt{{K}_{W}}$mol/L,则c(H+)=c(OH-),即溶液显中性,故C正确;
D.混合溶液中,c(H+)+c(B+)═c(OH-)+c(A-),即电荷守恒,在酸性、碱性、中性溶液中均存在电荷守恒,故D错误.
故选C.
点评 本题考查溶液的酸碱性的判断及电荷守恒的应用,题目难度不大,注意把握影响水的离子积的因素,在中性溶液中一定存在c(H+)=c(OH-).

练习册系列答案
相关题目
6.针对下面10种元素,完成以下各小题.回答下列间题.
(1)非金属性最强的元素是氟(填名称).化学性质最不活泼的元素是Ne(填元素符号).
(2)S 原子结构示意图为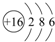 ;
;
(3)Mg和Al中,原子半径较小的是Al;
(4)N的氢化物的分子式NH3,该物质中N元素与H元素的质量比为14:3,(相对原子质量:N-14 H-1),其水溶液呈碱性性.
(5)元素硅的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(6)元素最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式),呈两性的是Al(OH)3(填化学式);两者反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)S 原子结构示意图为
 ;
;(3)Mg和Al中,原子半径较小的是Al;
(4)N的氢化物的分子式NH3,该物质中N元素与H元素的质量比为14:3,(相对原子质量:N-14 H-1),其水溶液呈碱性性.
(5)元素硅的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(6)元素最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式),呈两性的是Al(OH)3(填化学式);两者反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O.
7.R分子的质量为a g,相对质量为M,则M与a的比值等于( )
| A. | 6.02×1023 | B. | 12C原子质量的十二分之一 | ||
| C. | 0.012Kg12C所含的原子数 | D. | 1mol氧气所含的微粒数 |
4.青蒿素结构如图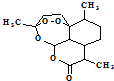 ,有关叙述正确的是d(选填序号).
,有关叙述正确的是d(选填序号).
a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
由青蒿酸为原料出发,经五步合成可得到青蒿素.其中第2步为还原反应: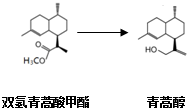
常温下即可反应且略放热,还原剂为LiAlH4.相关物质的性质:
某学习小组在实验室用双氢青蒿酸甲酯制取青蒿醇.
(1)反应中使用过量的氢化铝锂,理由是提高双氢青蒿酸甲酯的转化率.
为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是双氢青蒿酸甲酯不溶于水,氢化铝锂会与水反应.
(2)请设计实验室制备装置(画出草图):

(3)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂.从反应混合物中提取青蒿醇的方法是:
①加盐酸后分液;
②从乙醚层提取青蒿醇.有多种方法,以下是二种方案:
方案一:蒸发结晶. 方案二:蒸馏析出晶体.
a.这2个方案在析出晶体后都应有残留液,原因是防止氢青蒿酸甲酯析出.
b.请对这2个方案进行比较方案二可回收乙醚、甲醇.
 ,有关叙述正确的是d(选填序号).
,有关叙述正确的是d(选填序号).a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
由青蒿酸为原料出发,经五步合成可得到青蒿素.其中第2步为还原反应:

常温下即可反应且略放热,还原剂为LiAlH4.相关物质的性质:
| 物质 | 性质 |
| 双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂. |
| 青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂. |
| 乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点:34.6℃. |
| 氢化铝锂 | 固体,溶于乙醚. 与水反应:LiAlH4+4H2O→Al(OH)3↓+LiOH+4H2↑ 可将一分子酯还原成二分子醇,自身生成醇铝、醇锂. (醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇). |
(1)反应中使用过量的氢化铝锂,理由是提高双氢青蒿酸甲酯的转化率.
为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是双氢青蒿酸甲酯不溶于水,氢化铝锂会与水反应.
(2)请设计实验室制备装置(画出草图):

(3)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂.从反应混合物中提取青蒿醇的方法是:
①加盐酸后分液;
②从乙醚层提取青蒿醇.有多种方法,以下是二种方案:
方案一:蒸发结晶. 方案二:蒸馏析出晶体.
a.这2个方案在析出晶体后都应有残留液,原因是防止氢青蒿酸甲酯析出.
b.请对这2个方案进行比较方案二可回收乙醚、甲醇.
11.元素周期表中氧元素的数据见如图,说法正确的是( )
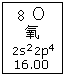

| A. | 氧元素的质量数是16 | |
| B. | 氧元素的相对原子质量是16.00 | |
| C. | 氧原子2p亚层有一个未成对电子 | |
| D. | 氧原子最外层有6个能量相同的电子 |
1.如图是模拟电化学反应装置图.下列说法正确的是( )
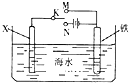

| A. | 若X为碳棒,开关K置于N处,可以加快铁的腐蚀 | |
| B. | 若X为碳棒,开关K置于N处,则X极附近溶液变黄色 | |
| C. | 若X为锌,开关K置于M处,保护铁电极则为牺牲阳极的阴极保护法 | |
| D. | 若X为锌,开关K置于M处,则X电极的反应式为:O2+4e+2H2O→4OH- |
8.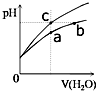 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、b、c三点溶液的离子浓度之和a>b>c | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,恰好反应时消耗NaOH溶液的体积Vb=Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
5.关于晶体的说法正确的是( )
| A. | 若晶体熔融状态下能导电,该晶体一定是离子晶体 | |
| B. | 若晶体熔化时化学键断裂,该晶体一定是原子晶体 | |
| C. | 若晶体中含有非极性分子,该晶体可能有较低的熔沸点 | |
| D. | 若晶体中含有极性共价键,该晶体不可能有很高的熔沸点 |
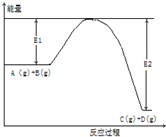 反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.