题目内容
碳和硅是同族元素,回答下列问题:
(1)CO2和SiO2都是非金属氧化物,分子中既有o键又有π键的是 .属于原子晶体的是 ,SiO2中原子轨道的杂化形式为 .
(2)碳和硅有关键键能如下表所示,简要分析解释下列有关事实:
①硅和碳都能形成系列氢化物,但硅烷在种类和数量上都远不如烷泾多,原因是 .
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 .
(1)CO2和SiO2都是非金属氧化物,分子中既有o键又有π键的是
(2)碳和硅有关键键能如下表所示,简要分析解释下列有关事实:
①硅和碳都能形成系列氢化物,但硅烷在种类和数量上都远不如烷泾多,原因是
②SiH4的稳定性小于CH4,更易生成氧化物,原因是
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-o |
| 键能(Kj/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
考点:碳族元素简介,不同晶体的结构微粒及微粒间作用力的区别
专题:
分析:(1)共价单键为σ键,共价双键中一个是σ键一个是π键,共价三键中一个是σ键两个是π键;依据形成不同晶体的作用和微粒判断晶体类型;依据二氧化硅空间构型判断原子轨道的杂化形式;
(2)物质的稳定性取决于化学键的强弱,依据硅烷、烷烃、甲烷含的化学键稳定性判断解答.
(2)物质的稳定性取决于化学键的强弱,依据硅烷、烷烃、甲烷含的化学键稳定性判断解答.
解答:
解:(1)CO2中存在C=O,所以既含有o键又有π键,SiO2中只含有Si-O,只含o键;二氧化碳分子通过分子间作用力形成分子晶体,二氧化硅中硅原子与氧原子通过共价键形成原子晶体;SiO2是空间网状结构,一个Si原子周围连有4个O原子,Si原子原子核外最外层有4个电子,恰好与氧原子形成4个σ键,无孤对电子,而杂化轨道用于形成σ键和容纳孤对电子,故SiO2中Si的杂化类型是sp3;
故答案为:CO2;SiO2;SP3;
(2)①由表中数据可知,C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成,
故答案为:C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成;
②由表中数据可知,C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键,
故答案为:C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
故答案为:CO2;SiO2;SP3;
(2)①由表中数据可知,C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成,
故答案为:C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成;
②由表中数据可知,C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键,
故答案为:C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
点评:本题考查了化学键的类型、晶体类型的判断、物质的性质与化学键之间的关系,明确物质的结构及化学键对物质性质的影响是解题关键,题目难度中等.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案
相关题目
下列操作方法或实验装置正确的是( )
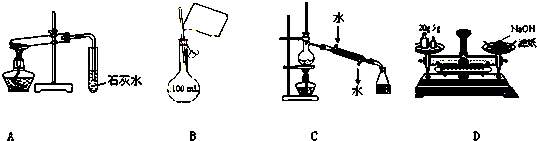

| A、装置探究NaHCO3的热稳定性 |
| B、配制100 mL 0.10 mol?L-1NaCl溶液 |
| C、实验室用该装置制取少量蒸馏水 |
| D、称量25 g NaOH |
下列说法正确的是( )
| A、常用危险化学品包括:强氧化剂、压缩气体、液化气体、放射性物质等 |
| B、以mol为单位,可以计量分子、原子、质子、电子、胶体粒子等微观粒子 |
| C、物质体积的大小,取决于组成物质粒子的大小和粒子间的距离 |
| D、制备蒸馏水时,当一出现馏出液时应立即收集 |
在4份碘化钾淀粉溶液中,分别加入下列物质,不能使溶液变蓝的是( )
| A、氯化氢 | B、溴水 |
| C、氯气 | D、碘的酒精溶液 |
下列过程中,需要降低化学反应速率的是( )
| A、制取氨气 | B、食物腐烂 |
| C、工业炼钢 | D、硫酸的生产 |
下列说法或表示不正确的是( )
| A、氯乙烯可通过加聚反应生成高分子化合物 |
| B、CaC2,MgCl2,Na2O2中都含有共价键 |
| C、由水电离出的e(H+)=1.0*10-5mol?L-1的溶液中,可能含有Fe3+,NH4+,MnO4-,SO42- |
| D、若只已知某物质的实验式为C2H5,仍确定其化学式 |
 前四周期元素A,B,C,D原子序数依次增大,A和B的价层电子只有一个单电子,且A-和B+的电子数相差8;C和D与B同周期,C和D的价层电子中未成对电子分别为4和2,且原子序数相差2.回答下列问题:
前四周期元素A,B,C,D原子序数依次增大,A和B的价层电子只有一个单电子,且A-和B+的电子数相差8;C和D与B同周期,C和D的价层电子中未成对电子分别为4和2,且原子序数相差2.回答下列问题: 如图表示一个精炼粗铜的电解池,电解液a选用CuSO4溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个精炼粗铜的电解池,电解液a选用CuSO4溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: