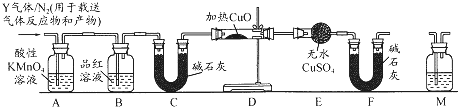
题目内容
11.元素X的原子最外层电子排布式为nsnnpn+l.原子中能量最高的是2p电子;元素X的氢化物的分子结构呈三角锥形;该氢化物可以与H+离子以配位键相合.分析 元素X的原子最外层电子排布式为nsnnpn+1,s能级最多排2个电子,该元素排列了p能级,说明s能级已经填满,所以n=2,则该元素最外层电子排布式为2s22p3,则该元素是N元素,氨气为三角锥分子,氨气可以与H+离子以配位键形成铵根离子.
解答 解:因为元素X的原子最外层电子排布式为nsnnn+1,np轨道已排上电子,说明ns轨道已排满电子,即n=2,则元素X的原子核外电子排布式为1s22s22p3,是氮元素,原子中能量最高的是2p电子,氨气为三角锥分子,氨气可以与H+离子以配位键形成铵根离子;
故答案为:2p;三角锥;配位.
点评 本题考查了原子核外电子排布,正确推断元素是解本题关键,难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
1.下列关于溶液的叙述正确的是( )
| A. | 将28.4g Na2SO4溶于水配成1000mL溶液,溶液中c (Na+)的物质的量浓度为0.2mol/L | |
| B. | 80 mL 1 mol•L-1氯化钠溶液中的c (Na+)与40 mL 1 mol•L-1碳酸钠溶液中的c (Na+) 相等 | |
| C. | 0.5 mol•L-1NaCl和0.5mol•L-1Na2SO4两溶液相比较,Na+的物质的量之比为1:2 | |
| D. | 4 mol•L-1的NaCl溶液稀释成100 mL 0.2molL-1的NaCl溶液,需4 mol•L-1的NaCl溶液的体积为5.0mL |
6.“关爱生命,拥抱健康”.人们在日常生活中的下列行为会损害人体健康的是( )
| A. | 用碳酸氢钠焙制糕点 | B. | 在易碎的食品包装袋中充入氮气 | ||
| C. | 炖排骨时滴加一定量的食醋 | D. | 用霉变花生(含黄曲霉素)压榨花生油 |
16.下列化学用语表示正确的是( )
| A. | 乙烯的结构简式:C2H4 | |
| B. | 铝的原子结构示意图: | |
| C. | H2O的结构式: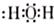 | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
20.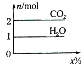 将甲,乙两种液体混合,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
将甲,乙两种液体混合,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
 将甲,乙两种液体混合,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
将甲,乙两种液体混合,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )| A | B | C | D | |
| 甲 | 戊烯 | 已烯 | 己二炔(C6H6) | 己烷 |
| 乙 | 环己烷(C6H12) | 苯 | 苯 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
8.下列说法正确的是( )
| A. | 氢气的燃烧热为△H=-285.5kJ•mol-1,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$2H2(g)+O2(g)△H=+285.5k•Jmol-1 | |
| B. | 反应SO2(g)+2H2S(g)═3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6k•Jmol-1 | |
| D. | 由C(石墨,s)=C(金刚石,s)△H=+1.90 k•Jmol-1可知,金刚石比石墨稳定 |